Antibakteriell resistens med vekt på betalaktamaser
Forfattere:
universitetsstipendiat. Institutt for oral biologi, Det odontologiske fakultet, Universitetet i Oslo, Norge
professor, dr. odont. Institutt for oral biologi, Det odontologiske fakultet, Universitetet i Oslo, Norge
Betalaktamantibiotika (penicilliner og cefalosporiner) er den største og mest benyttede gruppen av antibiotika i tannklinikken. Enzymer som bryter ned disse antibiotika, kalles betalaktamaser. De er den viktigste årsak til resistens overfor betalaktamantibiotika. Andre resistensmekanismer er endringer i egenskapene til penicillinbindende proteiner eller redusert permeabilitet i yttermembranen hos gramnegative bakterier. Det finnes mange forskjellige betalaktamaser med varierende aktivitet overfor ulike betalaktamantibiotika. Etterhvert som man har tatt i bruk nye betalaktamantibiotika med utvidet spektrum, har nye betalaktamaser dukket opp, såkalte «extended-spectrum» betalaktamaser, ESBL. Flere studier har påvist betalaktamaseproduserende bakterier i munnhulen. Disse bakteriene har redusert følsomhet overfor en rekke antibiotika. Sistnevnte bør derfor velges med utgangspunkt i dyrkning og resistensbestemmelse. Det finnes forbindelser som er i stand til å hemme betalaktamaser. Klavulansyre er en slik inhibitor og brukes i kombinasjon med amoxicillin (Augmentin®). Utstrakt bruk av antibiotika fremmer utvikling av resistens på infeksjonsstedet og utenfor dette. Munnhulens og tarmens normalflora kan tjene som reservoar for resistensgener som kan spres til mer patogene mikrober. Ettersom antibiotikaresistens de siste 10 – 15 årene har blitt et tiltakende helseproblem, er det viktig at tannleger fortsetter å være restriktive i bruken av antibiotika.
Den antibiotiske era har sitt utspring i Alexander Flemings berømte observasjon i 1928. Den skotske bakteriologen arbeidet med studier av stafylokokker da en av bakterieskålene ved et uhell ble forurenset med en muggsopp (Penicillium notatum) som forårsaket oppløsning av de tilstøtende bakteriene. Først ved utbruddet av andre verdenskrig, da forskere var i stand til å oppkonsentrere penicillin, kom Flemings oppdagelse til praktisk anvendelse. Allerede på samme tid ble det beskrevet et enzym som var i stand til å nøytralisere effekten av penicillin. Dette enzymet fikk senere betegnelsen betalaktamase. Et økende antall mikroorganismer som tidligere lett lot seg behandle, fremstår nå i resistente varianter (1). Hver gang antibiotika tas i bruk, øker sjansene for superinfeksjoner (2), samt utvikling og genetisk overføring av resistens. Munnhulens mikroflora kan tjene som reservoar for antibiotikaresistens som kan overføres til andre potensielt patogene mikroorganismer. Resistensproblematikken krysser i økende grad landegrenser, blant annet grunnet friere handel og økt reisevirksomhet. Kunnskap om resistensutvikling er nødvendig for å forstå problemet og delta i arbeidet med å motvirke den uheldige utviklingen.
Naturlig resistens |
Mikroorganismen mangler stukturer eller metabolske prosesser som det antimikrobielle midlet virker mot Artsspesifikk |
Ervervet resistens |
Mutasjon |
Transformasjon |
|
Transduksjon |
|
Konjugasjon |
Genetisk grunnlag for resistens
Resistens mot antimikrobielle midler kan være naturlig eller ervervet (Tabell 1) (3). Flere bakterier er naturlig resistente overfor visse antibiotika. Som eksempler fra munnhulens mikroflora kan nevnes Actinomyces-arter, Streptococcus-arter og Actinobacillus actinomycetemcomitans. Disse bakteriene mangler et essensielt enzym (nitroreduktase) som er nødvendig for å omdanne metronidazol til aktivt preparat ved normale terapeutiske konsentrasjoner. I tillegg er flere av munnhulens gramnegative anaerobe bakterier naturlig resistente overfor erytromycin på grunn av cellemembranstrukturen som forhindrer dette antibiotikumet å trenge inn i bakteriene (4).
Ved spontane mutasjoner i bakterienes DNA kan det oppstå varierende grad av resistens. Sannsynligheten for slike mutasjoner er størst ved infeksjoner hvor det foreligger et stort antall bakterier. Dersom antibiotika er tilstede i dette miljøet, kan vi få en seleksjon av resistente mutanter som overlever og deler seg raskt (5). I prosessen kalt transformasjon tar bakteriene opp fritt DNA fra omgivelsene og dette innlemmes i bakterienes kromosom. DNA som koder for resistens kan også overføres mellom bakterier ved hjelp av en bakteriofag, og mekanismen kalles da for transduksjon. Konjugasjon er en prossess som krever direkte cellekontakt og innebærer overføring av plasmider mellom bakteriene. Plasmider er ringformede, selvreplikerende DNA-tråder som kan kode for resistens.
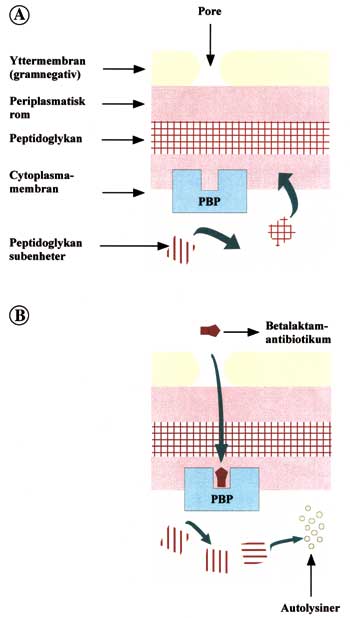
Fig. 1. A: De penicillinbindende proteinene (PBP) har en viktig funksjon i celleveggsyntesen. PBP katalyserer kryssbindingen av peptidkjedene i siste trinn av peptidoglykansyntesen. B: Betalaktamantibiotika kan entre cellen gjennom porer i yttermembranen (gramnegative bakterier) og hemme denne kryssbindingen. Resultatet av betalaktambinding er en intracellulær opphoping av peptidoglykan subenheter. Autolytiske enzymer aktiveres og bakterien går i oppløsning (Omarbeidet etter ref. 27).
Resistensgener kan også være flyttbare og kalles da transposoner. Plasmider utgjør de viktigste flyttbare resistensgener. Transposoner som er bærere av ett eller flere resistensgener, kan i tillegg overføres til selve kromosomet ved konjugasjon. I tillegg til overnevnte mekanismer skiller visse bakterier (enterokokker, streptokokker og stafylokokker) ut såkalte feromoner. Disse gjør at bakteriene klumper seg sammen og utveksler plasmider som kan inneholde resistensgener (6).
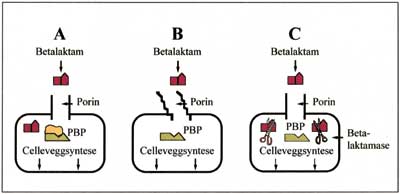
Fig. 2. Resistens mot betalaktamantibiotika oppstår når A: de penicillinbindende proteinene (PBP) endres slik at affiniteten for betalaktamantibiotika reduseres eller oppheves, B: porinene i yttermembranen til gramnegative bakterier endres og medikamentets penetrasjon inn til PBP hemmes, C: bakterien produserer enzymer (betalaktamaser) som bryter ned medikamentet.
Betalaktamantibiotika
Betalaktamantibiotika er fellesbetegnelsen på vår største og viktigste gruppe av antibiotika. Alle har i sin kjemiske struktur en betalaktamring. De ulike betalaktamer skilles på grunnlag av en annen ringstruktur (unntak monobaktamer) som er bundet til betalaktamringen. De viktigste hovedgruppene av betalaktamantibiotika er penicilliner, cefalosporiner, karbapenemer og monobaktamer. Hver av disse gruppene er representert i ulike antibakterielle midler.
Betalaktamantibiotika virker ved å binde seg til og hemme de såkalte penicillinbindende proteiner (PBP) i cellemembranen. Disse er involvert i dannelsen av peptidoglykan. Sistnevnte er en viktig del av celleveggen til både grampositive og gramnegative bakterier. En ufullstendig celleveggg vil føre til at bakteriene dør (Fig. 1) (7).
Resistensutvikling mot betalaktamantibiotika
Selv om de fleste bakterier inneholder PBP, blir ikke alle hemmet eller drept av betalaktamantibiotika. De tre hovedårsakene til dette er illustrert i Fig. 2 (8, 9).
Endring av PBP kan skje gjennom mutasjoner i de gener som koder for proteinene eller ved at bakteriene tar opp ekstra DNA som koder for nye PBP. Denne mekanismen ses hovedsaklig hos grampositive kokker. De siste årene har meticillinresistente gule stafylokokker blitt et problem i flere land. Resistensen skyldes et endret penicillinbindende protein hos disse stafylokokkene. Resistens som skyldes produksjon av PBP med nedsatt affinitet overfor antibiotika, er utbredt blant orale streptokokker som for eksempel Streptococcus oralis, S. sanguis og S. mitis.
Penetrasjonen av betalaktamantibiotika gjennom gramnegative bakteriers yttermembran skjer via hydrofile porer som dannes av proteiner og kalles poriner. Ulike antibiotika benytter det samme porinet når de trenger inn i gramnegative bakterier. Dersom tilgangen inn til PBP i cellemembranen hemmes via porinene, vil bakteriene kunne være resistente overfor flere antibiotika samtidig.
En rekke bakterier danner enzymer kalt betalaktamaser som opphever effekten av betalaktamantibiotika. Bakteriers dannelse av betalaktamaser utgjør den viktigste enkeltårsak til resistens overfor penicilliner, cefalosporiner og andre betalaktamforbindelser.
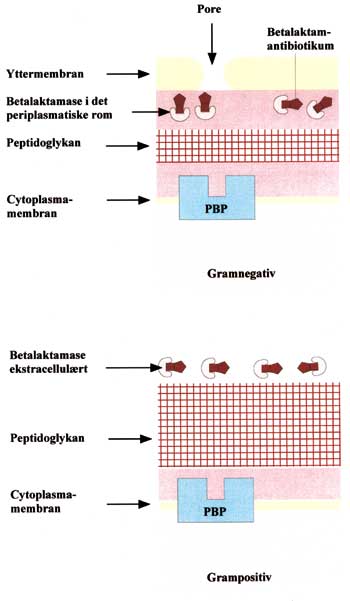
Fig. 3. Gramnegative bakterier har sine betalaktamaser lokalisert innenfor yttermembranen, mens grampositive bakterier kan skille ut store mengder av disse enzymene ekstracellulært. Betalaktamasene kan inaktivere betalaktamantibiotika før de når inn til målmolekylet (PBP) og dermed beskytte bakterien mot den antibakterielle effekten av medikamentene (Omarbeidet etter ref. 27).
Betalaktamaser
Bare få år etter at penicillin ble tatt i bruk oppdaget man betalaktamaseproduserende stafylokokker. Etterhvert som nye bredspektrede penicilliner og cefalosporiner kom på markedet, dukket det opp en hel rekke nye enzymer produsert også av gramnegative bakterier. Enzymene virker ved at de hydrolyserer betalaktamringen og derved opphever den antibakterielle effekten av betalaktamantibiotika. Grampositive bakterier kan skille ut store mengder av disse enzymene ekstracellulært, mens de gramnegative bakteriene har sine betalaktamaser lokalisert innenfor yttermembranen (Fig. 3). Ved blandingsinfeksjoner, som ofte er tilfellet ved orale infeksjoner, kan enzymer utskilt fra grampositive bakterier beskytte også andre mikroorganismer på infeksjonsstedet (4).
Bacteroides-arter |
Veillonella-arter |
Capnocytophaga-arter |
Streptococcus-arter |
Bacillus-arter |
Prevotella-arter |
Pseudomonas aeruginosa |
Fusobacterium nucleatum |
I dag finnes et stort antall betalaktamaser med ulik substratprofil. Noen er aktive overfor både penicillin og cefalosporin, mens andre er mer spesifikke og kalles da penicillinaser eller cefalosporinaser. Etterhvert som man har tatt i bruk nye betalaktamantibiotika med utvidet spektrum, har nye enzymer blitt utviklet og tilpasset for å utfordre de nye midlene. Slike mutante enzymer kalles «extended-spectrum» betalaktamaser (ESBL) og identifiseres nå i stort antall i kliniske prøver (8).
Betalaktamaseinhibitorer
Visse jordbakterier produserer forbindelser med en kjemisk struktur lik den til penicillin. De har en betalaktamring, men utøver liten eller ingen antimikrobiell aktivitet. Noen av disse forbindelsene har betalaktamaseinhiberende effekt. Klavulansyre, produsert av Streptomyces clavuligerus, var den første betalaktamaseinhibitor som kom i klinisk bruk. Klavulansyre brukes i kombinasjon med et penicillin. Det vanligste kombinasjonspreparatet i bruk i dag er Augmentin®. Det finnes også semisyntetiske inhibitorer, for eksempel sulbaktam og tazobaktam.
Betalaktamasene har som regel høy affinitet for overnevnte inhibitorer. En irreversibel binding oppstår og enzymene inaktiveres (10).
Betalaktamaser i den orale mikroflora
I de siste 10 – 15 årene har antibiotikaresistens i munnhulen blitt stadig mer alminnelig. Flere studier har påvist betalaktamaseproduserende bakterier i munnhulen (Tabell 2) (11 – 21). De første rapportene kom i 1980 da betalaktamaseproduserende bakterier ble isolert fra orale infeksjoner hvor penicillinbehandling ikke førte frem. Nyere litteratur viser at dominerende betalaktamaseproduserende orale bakterier ofte tilhører slekten Prevotella (21). Disse bakteriene har redusert følsomhet overfor en rekke antibiotika, men hemmes av Augmentin® (12, 21).
Antibiotika bør selekteres etter forutgående resistensbestemmelse. Dersom behandlingen må institueres før slike resultater foreligger, blir valget av antibiotikum empirisk. I slike tilfeller må resistensundersøkelser utføres senere for å vurdere om antibiotikavalget var riktig eller om et annet antibiotikum bør tas i bruk (22).
Betalaktamaser kan påvises direkte i bakterieisolater før resultatet av resistensundersøkelser foreligger. En vanlig og svært følsom metode er basert på nitrocefin, som er et cefalosporin med en betalaktamring. Dersom nitrocefin utsettes for en betalaktamaseproduserende bakterie, vil betalaktamringen hydrolyseres og en fargeforandring finne sted (13). Denne testen har begrensninger fordi induserbare betalaktamaser ikke blir oppdaget. Slike enzymer produseres bare dersom bakterien blir eksponert overfor et antibiotikum, og resistensundersøkelser med slik eksponering er nødvendig for å påvise at enzymene er tilstede.
Perspektiver
Antibiotikabehandling av dentale infeksjoner fører ofte til økologiske forskyvninger i normalfloraen i munnhulen og andre steder i kroppen. Dette kan føre til overvekst av potensielt patogene mikrober og påfølgende superinfeksjon (2). Utstrakt antibiotikabruk fremmer også utvikling av bakteriell resistens på infeksjonsstedet og utenfor dette, blant annet i tarmens normalflora. Resistente bakterier kan så spres gjennom direkte kontakt mellom mennesker, gjennom luftbårne partikler og via mat eller vann. Det er viktig å være klar over at munnhulens normalflora kan tjene som et reservoar for resistensgener som kan spres til mer patogene mikrober. Betalaktamresistente orale streptokokker med endrede PBP har de siste årene fått økende betydning som årsak til overføring av penicillinresistens til S. pneumonia (23 – 26).
Resistensutvikling i den orale mikroflora, spesielt overfor penicilliner og tetracykliner, er på fremmarsj. Det er derfor viktig at tannleger fortsetter å være restriktive i bruken av antibiotika.
English summary
Handal T, Olsen I.
Antibacterial resistance with special reference to beta-lactamases
20 – 24
Antimicrobial resistance is an increasing clinical problem, especially in connection with beta-lactam compounds. This is the largest and currently most widely used group of antibiotics. Resistance to beta-lactam antibiotics is usually mediated by beta-lactamase production. Other resistance mechanisms are altered penicillin-binding proteins (PBPs) or decreased permeability through the outer membrane of gramnegative bacteria. Beta-lactamases are widespread among both grampositive and gramnegative bacteria. Most act against both penicillins and cephalosporins while others are more specific. With the introduction of expanded-spectrum beta-lactams, new enzymes extending the substrate spectrum to include the newer drugs have evolved (extended-spectrum beta-lactamases, ESBLs). Several studies have demonstrated the presence of beta-lactamase-producing bacteria in the oral microflora, and these bacteria are often resistant to many different antibiotics. The choice of antibiotic should therefore be based on microbiological culture and susceptibility testing. Certain aerobic actinomycetes produce compounds, e.g. clavulanic acid, which are capable of inhibiting beta-lactamases. Augmentin‘, consisting of clavulanic acid packaged in combination with amoxicillin, is the most widely used combination drug and is effective against most beta-lactamase-producing bacteria isolated from the oral cavity. Antimicrobial treatment of dental infections may promote the emergence of bacterial resistance, both in the diseased sites and in the normal oral and intestinal flora. Several studies have reported that the oral microflora can act as a gene pool for antibiotic resistance, which may be acquired from and passed on to transient colonisers of the site. As prescribers of drugs, it is of utmost importance that dentists continue their restrictive use of antibiotics.
Referanser
1. Slavkin HC. Emerging and re-emerging infectious diseases: a biological evolutionary drama. J Amer Dent Assoc 1997; 128: 108 – 13.
2. Olsen I, Helovuo H, Løkken P. Antibiotikainduserte superinfeksjoner. Tema Antibiotika. Nor Tannlegeforen Tid 2002; 112: 46 – 49.
3. Hawkey PM. The origins and molecular basis of antibiotic resistance. Br Med J 1998; 317: 657 – 60.
4. Walker CB. The acquisition of antibiotic resistance in the periodontal microflora. Periodontology 2000 1996; 10: 79 – 88.
5. Levy SB. The challenge of antibiotic resistance. Sci Am 1998; 278: 46 – 53.
6. Marsh P, Martin MV. Antimicrobial therapy and prophylaxis for oral infections. In: Marsh P, Martin MV, editors. Oral Microbiology. 4th ed. Oxford: Wright; 1999.
7. Matagne A, Lamotte-Brasseur J, Frère JM. Catalytic properties of class A b-lactamases: efficiency and diversity. Biochem J 1998; 330: 581 – 98.
8. Pitout JD, Sanders CC, Sanders EW. Antimicrobial resistance with focus on beta-lactam resistance in gram-negative bacilli. Am J Med 1997; 103: 51 – 9.
9. Handal T, Olsen I. Antimicrobial resistance with focus on oral beta-lactamases. Eur J Oral Sci 2000; 108: 163 – 74.
10. Medeiros AA. Evolution and dissemination of b-lactamases accelerated by generations of b-lactam antibiotics. Clin Infect Dis 1997; 24: S19–S45.
11. Walker CB, Tyler KZ, Low SB, King CJ. Penicillin-degrading enzymes in sites associated with adult periodontitis. Oral Microbiol Immunol 1987; 2: 129 – 31.
12. Legg JA, Wilson M. The prevalence of beta-lactamase producing bacteria in subgingival plaque and their sensitivity to Augmentin. Br J Oral Maxillofac Surg 1990; 28: 180 – 4.
13. van Winkelhoff AJ, Winkel EG, Barendregt D, Dellemijn-Kippuw N, Stijne A, van der Velden U. Beta-lactamase-producing bacteria in adult periodontitis. J Clin Periodontol 1997; 24: 538 – 43.
14. Heimdahl A, von Konow L, Nord CE. Isolation of b-lactamase-producing Bacteroides strains associated with clinical failures with penicillin treatment of human orofacial infections. Archs Oral Biol 1980; 25: 689 – 92.
15. Heimdahl A, von Konow L, Nord CE. Beta-lactamase-producing Bacteroides species in the oral cavity in relation to penicillin therapy. J Antimicrob Chemother 1981; 8: 225 – 9.
16. Valdés MV, Lobbins PM, Slots J. Beta-lactamase producing bacteria in the human oral cavity. J Oral Pathol 1982; 11: 58 – 63.
17. Whitcher BL, Beirne OR, Smith RA. Beta-lactamase-producing Bacteroides melaninogenicus and osteomyelitis of the mandible. J Oral Med 1983; 38: 17 – 20.
18. Wasfy MO, Bajuscak RE, Santos AC, Minah GE. b-lactamase resistance of black-pigmented Bacteroides in gingival plaques of Egyptian children. J Periodontal Res 1986; 21: 450 – 4.
19. Kinder SA, Stanley CH, Korman KS. Penicillin resistance in the subgingival microbiota associated with adult periodontitis. J Clin Microbiol 1986; 23: 1127 – 33.
20. Nagy E, Szóke I, Gacs M, Csiszár K. Resistance to beta-lactam antibiotics and beta-lactamase production of Bacteroides, Porphyromonas and Prevotella strains. Acta Microbiol Immunol Hung 1995; 42: 287 – 99.
21. Fosse T, Madinier I, Hitzig C, Charbit Y. Prevalence of b-lactamase-producing strains among 149 anaerobic gram-negative rods isolated from periodontal pockets. Oral Microbiol Immunol 1999; 14: 352 – 7.
22. Koneman EW, Allen SD, Janda WM, Schreckenberger PC, Winn WC Jr. Antimicrobial Susceptibility Testing. In: Koneman EW, et al, editors. Color Atlas and Textbook of Diagnostic Microbiology. 5th ed. Philadelphia: Lippincott-Raven Publishers; 1997.
23. Chalkley L, Schuster C, Potgieter E, Hakenbeck R. Relatedness between Streptococcus pneumonia and viridans streptococci: transfer of penicillin resistance determinants and immunological similarities of penicillin-binding proteins. FEMS Microbiol Lett 1991; 69: 35 – 42.
24. Dowson CG, Coffey TJ, Kell C, Whiley RA. Evolution of penicillin resistance in Streptococcus pneumonia; the role of Streptococcus mitis in the formation of a low affinity PBP2B in S. pneumonia. Mol Microbiol 1993; 9: 635 – 43.
25. Reichmann P, König A, Liñares J, Alcaide F, Tenover FC, McDougal L, et al. A global gene pool for high-level cephalosporin resistance in commensal Streptococcus species and Streptococcus pneumonia. J Infect Dis 1997; 176: 1001 – 12.
26. König A, Reinert RR, Hakenbeck R. Streptococcus mitis with unusually high level resistance to beta-lactam antibiotics. Microb Drug Resist 1998; 4: 45 – 9.
27. Mims C, Playfair J, Roitt I, Wakelin D, Williams R. Antimicrobial agents and chemotherapy. In: Mims C, et al, editors. Medical Microbiology. London: Mosby; 1998.
Antibiotika; Infeksjon; Oral medisin.
Adresse: Trude Handal, Institutt for oral biologi, postboks 1052 Blindern, N-0316 Oslo, Norge. E-post: thandal@odont.uio.no