Antibiotika – medikamentelle interaksjoner
Forfattere:
professor, dr. odont. Seksjon for odontologisk farmakologi og farmakoterapi, Institutt for klinisk odontologi, Det odontologiske fakultet, Universitetet i Oslo, Norge
professor, dr. odont. Institutt for oral biologi, Det odontologiske fakultet, Universitetet i Oslo, Norge
overlege, professor, dr. med. Avdeling for legemidler, Regionsykehuset i Trondheim, Norge.
Interaksjoner mellom medikamenter har klinisk betydning når de endrer et legemiddels terapeutiske effekt eller øker dets toksisitet. For noen antibiotika (f. eks. tetracykliner og fluorokinoloner) kan interaksjoner med legemidler i mavetarmkanalen redusere absorpsjonen slik at den tilsiktede antimikrobielle effekt ikke oppnås. I det siste 10-året er det vist at cytokrom P450 (CYP)-enzymene er en viktig arena for medikamentelle interaksjoner. Erytromycin er en potent hemmer av CYP3A4 som metaboliserer svært mange forskjellige legemidler. Visse antifungale stoffer som itrakonazol og ketokonazol er også kraftige hemmere av CYP3A4, mens flukonazol hemmer CYP2C9 og ciprofloksacin hemmer CYP1A2. Den som gir et slikt antibiotikum til en pasient, må alltid være oppmerksom på muligheten for uønskede eller farlige interaksjoner. Risikoen er størst når interaksjonen involverer legemidler med smal terapeutisk bredde, for eksempel warfarin, digitalisglykosider, antiarytmika, antiepileptika og ciklosporin. Dokumentasjonen for p-pillesvikt ved antibiotikabehandling er usikker. Litteraturen gir ikke noen entydig anbefaling, men man bør overveie å gi råd om å benytte annen prevensjon i tiden antibiotikumet tas og i noen dager etter avsluttet kur. Selv om alvorlige interaksjoner ikke forekommer ofte og ikke heller rammer alle som får en bestemt kombinasjon, krever samtidig bruk av flere legemidler alltid skjerpet årvåkenhet. Eldre, som ofte bruker mange legemidler, er særlig utsatt.
Et legemiddel (A) kan forandre virkningen av et annet (B) ved:
En farmakodynamisk interaksjon – A modifiserer Bs effekt på virkningsstedet uten å forandre konsentrasjonen av B.
En farmakokinetisk interaksjon – A fører til at konsentrasjonen av B som når virkningsstedet forandres ved å påvirke Bs absorpsjon, fordeling, proteinbinding, biotransformering eller utskillelse.
En interaksjon har klinisk betydning hvis den endrer et legemiddels terapeutiske virkning eller øker dets toksisitet. Mange interaksjoner er ønskelige og tilsiktede, som for eksempel kombinasjon av flere medikamenter ved behandling av hjerte- og karsykdommer eller kreft. Denne artikkelen tar for seg uønskede interaksjoner mellom antibiotika og andre medikamenter. Generelt vet man langt mindre om farmakodynamiske enn om farmakokinetiske interaksjoner, blant annet fordi førstnevnte ofte er vanskeligere å måle og kvantifisere (1).
På grunnlag av den nå tilgjengelige kunnskap er det visse farmakokinetiske interaksjoner som det må forutsettes at tannleger kjenner til. Særlig viktige er interaksjoner som skyldes induksjon eller inhibisjon av cytokrom P450 (CYP)-systemet i leveren. Ved administrasjon av antibiotika (f. eks. erytromycin og noen midler mot sopp) som blokkerer visse CYP-enzymers metabolisme av andre legemidler, kan det hos noen pasienter oppstå livstruende situasjoner. Ikke minst fordi det meste av denne kunnskapen er forholdsvis ny, kan det være grunn til å se litt nærmere på dette viktige enzymsystemet.
Cytokrom P450 (CYP)-systemet
I dette mer enn 3,5 milliarder år gamle systemet har det etter hvert oppstått flere hundre isoenzymer. CYP-enzymene er heminneholdende membranproteiner lokalisert i cellenes glatte endoplasmatiske retikulum. De gir leveren dens rødbrune farve og utgjør ca. 0,5 % av leverproteinet, men de finnes også i mange andre organer. Hovedprinsippet for metabolisme av legemidler og andre fremmedstoffer er å gjøre stoffene mindre fettoppløselige og mer polare (vannoppløselige), slik at de utskilles lettere. For mange stoffer skjer dette i to faser. I fase I, som CYP-enzymene er hovedansvarlig for, kan man forenklet si at det festes en «krok» (f. eks. en OH-gruppe) på molekylet. I fase 2 kobles det på denne «kroken» en gruppe med svært lav fettoppløselighet (f. eks. glukuronsyre). CYP-systemet har både fysiologiske funksjoner (f. eks. i syntese og metabolisme av steroidhormoner) og en kollektiv kapasitet som gir mulighet til å reagere med et stort antall fremmedstoffer, inklusive mange stoffer som ennå ikke er oppfunnet. Genetisk betingede forskjeller i CYP-enzymene er en svært viktig årsak til de store interindividuelle variasjoner i metabolisme og effekter av legemidler.
Hos mennesket er det identifisert 12 CYP-familier med forskjellige subfamilier og medlemmer. De viktigste CYP-enzymenes andeler i biotransformeringen av farmaka illustreres i Fig. 1. Som figuren viser er CYP3A4 involvert i omdannelsen av flest medikamenter. Tabell 1 presenterer et utvalg av de mange legemidler som er substrater for CYP3A4, samt noen stoffer som hemmer eller induserer dette enzymet. Farmaka som interfererer med dette systemet påvirker derved konsentrasjoner og effekter av et stort antall legemidler som anvendes på mange forskjellige indikasjoner.
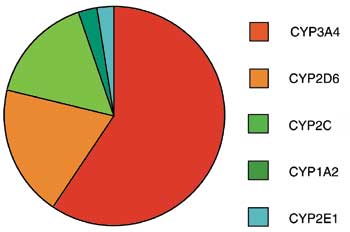
Fig. 1. Relative andeler av antall farmaka som metaboliseres av viktige cytokrom P450-enzymer. Et legemiddel kan metaboliseres av flere slike enzymer. Omtegnet etter ref. 23.
Substrater |
Inhibitorer |
Induktorer |
|---|---|---|
Makrolidantibiotika: erytromycin, klaritromycin |
Erytromycin, |
Karbamazepin, |
Antimykotika: itrakonazol, ketokonazol |
klaritromycin, |
fenobarbital, |
Antiarytmika: kinidin |
ketokonazol, |
fenytoin, |
Benzodiazepiner: alprazolam, midazolam, triazolam |
itrakonazol, |
griseofulvin, |
Immunmodulatorer: ciklosporin, takrolimus |
mikonazol, |
rifampicin, |
Hiv-protease-inhibitorer: indinavir, ritonavir, saquinavir, |
||
nelfinavir, m. fl. |
ritonavir, |
johannesurt |
Antihistaminer: terfenadin, loratadin, klorfeniramin |
nefazodon, |
|
Kalsiumantagonister: diltiazem, felodipin, nifedipin, |
||
verapamil, m. fl. |
grapefruktsaft |
|
HMG-CoA reduktasehemmere (statiner): lovastatin, |
||
simvastatin, atorvastatin |
||
Forskjellige: buspiron, cisaprid, metadon, sildenafil, |
||
pimozid, finasterid, ropivakain, lidokain, m. fl. |
Induksjon – Dette innebærer enzymsyntese ved eksponering for et legemiddel. Det vil derved øke sin egen, men også andre legemidlers omdannelseshastighet. Mer enn 200 farmaka er rapportert å virke som enzyminduktorer (2). Induksjon inntrer først etter noen dagers behandling og når vanligvis maksimum etter 1 – 3 uker (1). Av antimikrobielle stoffer virker særlig rifampicin og griseofulvin induserende, men disse midlene er det neppe aktuelt for tannleger å administrere.
Inhibisjon – For tannleger er det aktuelt å benytte noen av de antimikrobielle stoffene som hemmer forskjellige CYP-enzymer. Dette kan føre til forhøyede konsentrasjoner av utgangsstoffene, forlengede farmakologiske effekter og fare for bivirkninger og toksiske reaksjoner. I motsetning til situasjonen ved induksjon, kan inhibisjon manifestere seg allerede første døgn, men det kan ta opptil 3 – 5 døgn før inhibisjonen er maksimal. I det følgende redegjøres for noen aktuelle interaksjoner av denne type.
Hemmere av CYP3A4
Visse makrolider (f. eks. erytromycin) og antifungale stoffer (f. eks. itrakonazol og ketokonazol) er kraftige hemmere av CYP3A4. Den som administrerer et slikt antibiotikum til en pasient, må alltid være oppmerksom på muligheten for mange og til dels farlige interaksjoner (3).
Blant de legemidler som erytromycin kan føre til skadelige interaksjoner med er karbamazepin, ciklosporin, lovastatin, midazolam, triazolam, pimozid, terfenadin og cisaprid (Tabell 2). Toksisiteten ved slike interaksjoner skyldes vanligvis en forsterket farmakologisk effekt, som ved en overdose. Noen kombinasjoner er spesielt risikofylte. Ved koadministrasjon av erytromycin og antihistaminet terfenadin kan det oppstå livstruende ventrikulære arytmier (4). Slike arytmier kan også utløses dersom erytromycin kombineres med cisaprid, et legemiddel som benyttes til å regulere gastrointestinal motilitet (1). Erytromycin kan allerede etter svært kort tids bruk føre til toksiske konsentrasjoner av karbamazepin, fordi CYP3A4-mediert omdannelse av karbamazepin blokkeres (5).
Det er forskjeller mellom makrolidene i binding til og hemning av CYP3A4. De klassifiseres vanligvis i tre grupper (5):
Gruppe I (erytromycin og troleandomycin) hemmer CYP3A4 kraftig. Disse er rapportert å ha ført til toksiske konsentrasjoner av mange medikamenter.
Gruppe II (klaritromycin) har middels bindingsaffinitet til CYP3A4.
Gruppe III (azitromycin og diritromycin) som i liten grad binder seg til CYP3A4 og er assosiert med færrest skadelige interaksjoner.
Itrakonazol og ketokonazol er, som erytromycin, kraftige inhibitorer av CYP3A4 og hemmer metabolismen av det samme brede spektrum av legemidler (Tabell 3). Flukonazol hemmer i liten grad CYP3A4.
For stoffer som i stor grad inaktiveres av CYP3A4 ved passasjen gjennom tarmvegg og lever (første-passasje-metabolisme), kan enzyminhibisjon gi bemerkelsesverdige utslag. Dette kan illustreres med effekten av itrakonazol på metabolismen av to benzodiazepiner som er aktuelle mot tannbehandlingsangst, midazolam og triazolam. I placebo-kontrollerte studier med friske frivillige forsøkspersoner økte itrakonazol den maksimale plasmakonsentrasjon av midazolam tre ganger og arealet under konsentrasjonskurven (AUC) for midazolam ble ti ganger større (6). Tilsvarende økte itrakonazol maksimalkonsentrasjonen av triazolam tre ganger og AUC for triazolam hele 27 ganger (7). Erytromycin økte AUC for midazolam 4 – 5 ganger, mens klaritromycin økte AUC for midazolam til det 3-dobbelte (8, 9). Når det til tross for benzodiazepinenes meget utbredte bruk som sedativa og hypnotika kun foreligger få kliniske rapporter om interaksjoner med hemmere av CYP3A4, beror antakelig dette på benzodiazepinenes meget store terapeutiske bredde (4).
Antibakterielt stoff (A), annet medikament (B) |
Effekt |
Klinisk relevansa |
|---|---|---|
Erytromycin |
||
Alprazolam |
Øket konsentrasjon av B |
2 |
Bromokriptin |
Øket konsentrasjon av B |
2 |
Buspiron |
Øket konsentrasjon av B |
1 |
Ciklosporin |
Øket konsentrasjon av B |
1 |
Cisaprid |
Øket konsentrasjon av B |
1 |
Digitoksin |
Øket konsentrasjon av B |
1 |
Digoksin |
Øket konsentrasjon av B |
1 |
Disopyramid |
Øket konsentrasjon av B |
2 |
Ergotamin |
Øket konsentrasjon av B |
1 |
Felodipin |
Øket konsentrasjon av B |
1 |
Karbamazepin |
Øket konsentrasjon av B |
1 |
Klozapin |
Øket konsentrasjon av B |
2 |
Lovastatin |
Øket konsentrasjon av B |
1 |
Midazolam |
Øket konsentrasjon av B |
1 |
Pimozid |
Øket konsentrasjon av B |
1 |
Sildenafil |
Øket konsentrasjon av B |
2 |
Simvastatin |
Øket konsentrasjon av B |
1 |
Takrolimus |
Øket konsentrasjon av B |
1 |
Teofyllin |
Øket konsentrasjon av B |
1 |
Terfenadin |
Øket konsentrasjon av B |
1 |
Triazolam |
Øket konsentrasjon av B |
2 |
Warfarin |
Øket konsentrasjon av B |
2 |
Klaritromycin |
||
Ciklosporin |
Øket konsentrasjon av B |
1 |
Cisaprid |
Øket konsentrasjon av B |
1 |
Digitoksin |
Øket konsentrasjon av B |
1 |
Digoksin |
Øket konsentrasjon av B |
1 |
Disopyramid |
Øket konsentrasjon av B |
1 |
Karbamazepin |
Øket konsentrasjon av B |
1 |
Lovastatin |
Øket konsentrasjon av B |
2 |
Midazolam |
Øket konsentrasjon av B |
1 |
Pimozid |
Øket konsentrasjon av B |
1 |
Simvastatin |
Øket konsentrasjon av B |
1 |
Takrolimus |
Øket konsentrasjon av B |
1 |
Teofyllin |
Øket konsentrasjon av B |
1 |
Terfenadin |
Øket konsentrasjon av B |
1 |
Warfarin |
Øket konsentrasjon av B |
2 |
Azitromycin |
||
Digitoksin |
Øket konsentrasjon av B |
1 |
Digoksin |
Øket konsentrasjon av B |
1 |
Lovastatin |
Øket konsentrasjon av B |
2 |
Fluorokinoloner |
||
Di- og trivalente kationerb |
Redusert konsentrasjon av A |
1 |
Teofyllin |
Øket konsentrasjon av Bc |
2 |
Tetracykliner |
||
Di- og trivalente kationerb |
Redusert konsentrasjon av A |
1 |
Fenobarbital |
Redusert konsentrasjon av Ad |
2 |
Fenytoin |
Redusert konsentrasjon av Ad |
2 |
Karbamazepin |
Redusert konsentrasjon av Ad |
2 |
Sulfonamider |
||
Fenytoin |
Øket konsentrasjon av B |
1 |
Glibenklamid |
Øket konsentrasjon av B |
1 |
Glipizid |
Øket konsentrasjon av B |
1 |
Metotreksat |
Øket konsentrasjon av B |
1 |
Warfarin |
Øket konsentrasjon av B |
1 |
Metronidazol |
||
Ciklosporin |
Øket konsentrasjon av B |
1 |
Etanol |
Disulfiram-lignende reaksjon |
1 |
Fenytoin |
Øket konsentrasjon av B |
2 |
Karbamazepin |
Øket konsentrasjon av B |
2 |
Litium |
Øket konsentrasjon av B |
1 |
Warfarin |
Øket konsentrasjon av B |
1 |
Hemmere av CYP1A2
Fluorokinolonene hemmer i varierende grad CYP1A2. Mens ofloksacin gir liten hemning, kan ciprofloksacin resultere i akkumulering og toksisitet av CYP1A2-substrater som teofyllin (5). Ved å hemme metabolismen av koffein via CYP1A2 kan ciprofloksacin øke den maksimale koffeinkonsentrasjonen og forlenge halveringstiden 4 – 5 ganger (5), og medføre overdoseringsymptomer som søvnproblemer, hjertebank, rastløshet og angst. Det kan være relevant å opplyse om dette eksempelvis til eldre og individer som drikker mye kaffe.
Hemmere av CYP2C9
De to antifungale stoffene flukonazol og mikonazol hemmer CYP2C9. Det samme gjør sulfametoksazol (10), et sulfonamid som ofte brukes i kombinasjon med trimetoprim. Dersom flukonazol, mikonazol eller sulfametoksazol gis til pasienter som behandles med CYP2C9-substrater med smal terapeutisk bredde (f. eks. warfarin eller fenytoin), kan dette resultere i klinisk signifikante interaksjoner (10). Også metabolismen av perorale antidiabetika kan hemmes ved kombinasjonsbehandling med disse CYP2C9-hemmerne.
Selv ved overflateapplikasjon av mikonazolgel i munnhulen er det rapportert så kraftig forsterket warfarineffekt at det i enkelte tilfeller har medført sykehusinnleggelse (11, 12).
Metronidazol
På grunn av risiko for disulfiram-(Antabus®)-lignende intoleransesyndrom frarådes bruk av alkohol under og i minst tre dager etter avsluttet behandling med metromidazol. Symptomene skyldes opphopning av acetaldehyd på grunn av hemning av enzymet acetaldehyd dehydrogenase. Vanligvis er dette en mer ubehagelig enn farlig reaksjon.
Administrasjon av metronidazol til manisk-depressive pasienter som behandles med litium kan føre til toksiske konsentrasjoner av litium (4). Dette skyldes ikke interaksjon med biotransformasjon, men hemning av renal ekskresjon. For å unngå toksiske reaksjoner med forvirring, ataksi og nyreskade, anbefales kontroll av serumlitium-konsentrasjonen ved eventuell samtidig behandling med metronidazol.
Antibakterielt stoff (A), annet medikament (B) |
Effekt |
Klinisk relevansb |
|---|---|---|
Ketokonazol |
||
Alprazolam |
Øket konsentrasjon av B |
1 |
Antacidac |
Redusert konsentrasjon av A |
1 |
Ciklosporin |
Øket konsentrasjon av B |
1 |
Cisaprid |
Øket konsentrasjon av B |
1 |
Fenytoin |
Redusert konsentrasjon av A |
1 |
Karbamazepin |
Øket konsentrasjon av B |
2 |
Midazolam |
Øket konsentrasjon av B |
1 |
Rifampicin |
Redusert konsentrasjon av A |
2 |
Sildenafil |
Øket konsentrasjon av B |
2 |
Simvastatin |
Øket konsentrasjon av B |
1 |
Takrolimus |
Øket konsentrasjon av B |
1 |
Terfenadin |
Øket konsentrasjon av B |
1 |
Triazolam |
Øket konsentrasjon av B |
1 |
Warfarin |
Øket konsentrasjon av B |
2 |
Itrakonazol |
||
Antacidac |
Redusert konsentrasjon av A |
2 |
Atorvastatin |
Øket konsentrasjon av B |
1 |
Buspiron |
Øket konsentrasjon av B |
1 |
Ciklosporin |
Øket konsentrasjon av B |
1 |
Digoksin |
Øket konsentrasjon av B |
1 |
Felodipin |
Øket konsentrasjon av B |
1 |
Fenytoin |
Redusert konsentrasjon av A |
1 |
Karbamazepin |
Redusert konsentrasjon av A |
1 |
Lovastatin |
Øket konsentrasjon av B |
1 |
Midazolam |
Øket konsentrasjon av B |
1 |
Nifedipin |
Øket konsentrasjon av B |
1 |
Rifampicin |
Redusert konsentrasjon av A |
1 |
Sildenafil |
Øket konsentrasjon av B |
2 |
Simvastatin |
Øket konsentrasjon av B |
1 |
Takrolimus |
Øket konsentrasjon av B |
1 |
Terfenadin |
Øket konsentrasjon av B |
1 |
Triazolam |
Øket konsentrasjon av B |
1 |
Warfarin |
Øket konsentrasjon av B |
2 |
Flukonazol |
||
Ciklosporin |
Øket konsentrasjon av B |
1 |
Cisaprid |
Øket konsentrasjon av B |
1 |
Felodipin |
Øket konsentrasjon av B |
1 |
Fenytoin |
Øket konsentrasjon av B |
1 |
Glibenklamid |
Øket konsentrasjon av B |
1 |
Glipizid |
Øket konsentrasjon av B |
1 |
Midazolam |
Øket konsentrasjon av B |
2 |
Nifedipin |
Øket konsentrasjon av B |
1 |
Takrolimus |
Øket konsentrasjon av B |
1 |
Terfenadin |
Øket konsentrasjon av B |
2 |
Triazolam |
Øket konsentrasjon av B |
2 |
Warfarin |
Øket konsentrasjon av B |
1 |
Mikonazol |
||
Ciklosporin |
Øket konsentrasjon av B |
2 |
Cisaprid |
Øket konsentrasjon av B |
1 |
Fenytoin |
Øket konsentrasjon av B |
1 |
Glibenklamid |
Øket konsentrasjon av B |
2 |
Warfarin |
Øket konsentrasjon av B |
1 |
Gastrointestinal absorpsjon
Ved noen interaksjoner i mave-tarm-kanalen kan absorpsjonen av det antibiotikum som gis reduseres slik at det ikke gir den tilsiktede antimikrobielle effekt. Ved andre interaksjoner forandrer det antibiotikum som gis absorpsjonen av andre legemidler, for eksempel ved å påvirke tarmfloraen.
Tetracykliner og fluorokinoloner – Det er velkjent at absorpsjonen av tetracykliner reduseres ved kelatdannelse med to- og treverdige kationer som jern, aluminium, magnesium, sink og kalsium. Dette kan føre til inadekvate serumkonsentrasjoner. Tilbøyeligheten til dette varierer imidlertid, og doksycyklin affiseres i minst grad av tetracyklinene (4). Også absorpsjonen av fluorokinoloner reduseres ved kompleksdannelse med to- og treverdige kationer. Absorpsjonen kan reduseres med opptil 90 % (13). Tetracykliner og fluorokinoloner bør derfor gis minst 2 – 3 timer forskjøvet i forhold til inntak av melk, antacida, jern- og sinkpreparater (1).
Antimykotika – Ketokonazol er en svak base som bare har god oppløselighet ved lav pH. Medikamenter som øker pH i magesekken, f. eks. antacida, histamin H2-antagonister og protonpumpehemmere, reduserer derfor absorpsjonen av ketokonazol. Økning av pH affiserer imidlertid ikke absorpsjonen av flukonazol (3).
Digitalisglykosider – Digoksin og digitoksin har smal terapeutisk bredde, slik at en økning i serumkonsentrasjonen kan ha alvorlige konsekvenser. Mens de fleste absorberer ca. 75 % av digoksin gitt peroralt, har omtrent 10 % av pasientene en bakterieflora i tarmen (Eubacterium lentum) som fører til betydelig mindre opptak. Behandles disse med antiinfektiva som tetracyklin, erytromycin eller trimetoprim øker opptaket. Behandling i 3 – 6 dager med erytromycin kan f. eks. doble serumkonsentrasjonen av digoksin (4).
P-piller – Tilgjengelig informasjon indikerer at behandling med antibiotika innebærer en liten og uforutsigbar risiko for prevensjonssvikt (14). Det er vanskelig å fastslå hvor stor og reell risikoøkningen er, fordi det normalt forekommer ca. 1 – 3 % graviditeter pr. år hos brukere av p-piller (13). Det er sannsynligvis langt mindre enn 1 % risiko for å bli gravid om man kombinerer antibiotika med p-piller (15). Risikoen for å bli gravid ved bruk av p-piller i kombination med antibiotika er dermed ikke vesentlig forskjellig fra risikoen ved bruk av vanlig kobberspiral, hvilket gir en akseptabel graviditetsbeskyttelse for kvinner flest. Risikoen er størst ved bruk av bredspektrede antibiotika og hos kvinner som har mellomblødninger på den aktuelle p-pille, noe som er et tegn på marginale østrogennivåer.
Det er postulert flere mekanismer hvorved antibiotika kan redusere effektiviteten av p-piller (14). Den ene hovedtypen av p-piller (kombinasjonspillen) inneholder både østrogen og gestagen, den andre (minipillen) inneholder bare gestagen. Det er holdepunkter for at samtidig bruk av østrogenholdige p-piller og antibakterielle midler (vist for amoksicillin, pivampicillin og tetracyklin) kan gi nedsatt antikonsepsjonseffekt (1). Årsaken er trolig at tarmbakterier normalt hydrolyserer inaktivt konjugert etinyløstradiol som skilles ut via gallen til fritt østrogen som derved kan reabsorberes og bidra til tilstrekkelig høy blodkonsentrasjon. Minipiller interagerer ikke med antibiotika.
Selv om dokumentasjonen for at antibiotika kan forårsake p-pillesvikt er usikker og slike graviditeter eventuelt er sjeldne, blir amerikanske tannleger anbefalt å nevne denne muligheten for aktuelle pasienter (4). I USA er det faktisk hevdet at unnlatelse kan medføre ansvar for tannlegen ved en eventuell uønsket fødsel, inkludert betaling av barnebidrag (16). Litteraturen gir ellers ikke noen entydig anbefaling, men man bør overveie å gi råd om benyttelse av annen prevensjon i tiden antibiotikumet tas og i noen dager etter avsluttet kur, i alle fall ved samtidig behandling med et bredspektret antibiotikum.
Warfarin og dikumarol – Disse legemidlene hemmer blodstansningsfunksjonen ved kompetitiv antagonisme med vitamin K-avhengige koagulasjonsfaktorer. Via forskjellige typer interaksjoner kan mange forskjellige medikamenter øke eller redusere effekten av disse vitamin K-antagonistene. Tarmbakterier syntetiserer vitamin K og bidrar til kroppens behov for dette vitamin. Eliminasjon av tarmbakterier ved behandling med antibiotika kan følgelig øke protrombintiden og INR («International Normatized Ratio») hos pasienter som i utgangspunktet er adekvat kontrollert med warfarin (17). Dette gjelder særlig ved bruk av bredspektrede antibiotika som tetracykliner og amoksicillin og hos pasienter med lavt inntak av vitamin K (4). På den annen side kan dikloksacillin, kloksacillin, griseofulvin og rifampicin redusere antikoagulasjonseffekten, sannsynligvis via induksjon av enzymer som biotransformerer vitamin K-antagonister (18). Ved administrasjon av antibiotika til pasienter som behandles med warfarin eller andre vitamin K-antagonister bør effekten av disse kontrolleres med INR-målinger for å sikre at pasienten forblir i terapeutisk nivå.
Varierende fokus på interaksjonsrisikoen
I en orientering til tannleger i USA om «Adverse drug interactions in dental practice: interactions involving antibiotics», gis interaksjonen mellom metronidazol og litium «Severity rating: Major» (4). Denne interaksjon nevnes imidlertid ikke i en anerkjent lærebok i indremedisin (19). Dette er ett av en rekke eksempler på at forskjellige informasjonskilder varierer i deres vektlegging av hvilke interaksjoner som har størst klinisk signifikans. Litteraturen om medikamentelle interaksjoner er stor, kompleks og uoversiktlig, og ikke sjelden finner man forskjellig informasjon i ulike oppslagsverk.
Implikasjoner for tannlegen
En tannlege med autorisasjon til å forskrive og administrere legemidler er ansvarlig for best mulig å forsikre seg om at skadelige medikamentelle interaksjoner ikke oppstår som følge av terapeutiske intervensjoner. Før behandling med et legemiddel starter, må tannlegen utrede hvilke andre medikamenter pasienten bruker og om noen av disse innebærer risiko for klinisk signifikante interaksjoner med det som vurderes gitt. Antibiotika forskrives ofte til pasienter som tar andre medikamenter.
Tannlegen bør kjenne til at administrasjon av makrolider, visse antimykotika og metronidazol innebærer risiko for potensielt farlige interaksjoner. Er det aktuelt å forskrive slike antimikrobielle stoffer, og pasienten bruker medikamenter som tannlegen ikke har gode kunnskaper om, må tannlegen basere seg på bruk av oppslagsbøker og andre relevante informasjonskilder. I det «computeriserte» tannlegekontor vil databaseprogram være ideelt for dette formål (20). På grunnlag av listen over medikamenter som pasienten bruker, samt det medikament som vurderes gitt, vil datamaskinen automatisk kunne liste opp potensielle interaksjoner med linker til relevant tilleggsinformasjon. En oppdatert norsk database over legemiddelinteraksjoner er tilgjengelig på Internett (21).
Graden av interaksjon og kliniske konsekvenser viser store både inter- og intra-individuelle variasjoner (5), avhengig av blant annet genetiske, patofysiologiske eller ernæringsmessige forhold (22). Selv om skadelige interaksjoner ofte bare rammer de færreste som får en bestemt kombinasjon, krever samtidig bruk av flere legemidler alltid skjerpet årvåkenhet. Eldre, som ofte bruker mange legemidler, er særlig utsatt.
English summary
Løkken P, Olsen I, Spigset O.
Antibiotics – drug interactions
36 – 41.
Although many interactions have been described in the medical literature, few interactions between antibiotics and other drugs have serious clinical implications. The bioavailability of some orally administered antibiotics (e. g. tetracyclines and fluoroquinolones) may be greatly reduced by interactions within the gastrointestinal tract, leading to poor antibiotic efficacy. The inhibition or induction of certain cytochrome P450 (CYP) enzymes by drugs is generally regarded as the most important mechanism of drug interactions. Some macrolides (e. g. erythromycin) and antifungal agents (e. g. itraconazole and ketoconazole) are potent inhibitors of the major drug-metabolising CYP isoform, CYP3A4. Coadministration of these drugs with CYP3A4 substrates (e. g. cyclosporin, midazolam, nifedipine, simvastatin and terfenadine) can result in clinically significant drug interactions, some of which can be life-threatening. Coadministration of fluconazol, which inhibits CYP2C9, and CYP2C9 substrates (e. g. phenytoin and warfarin) may also result in clinically significant drug interactions. The concern applies particularly to drugs with a narrow therapeutic margin, such as warfarin, cardiac glycosides, antiarrhythmics, antiepileptics and cyclosporin. The association between use of antibiotics and oral contraceptive failure is disputed and weak. Dentists are nevertheless advised to discuss this possible interaction when appropriate. A meticulous drug history is essential. Although serious drug interactions are infrequent and might be unpredictable in an individual patient, increased alertness is always required when drugs are used concomitantly. This particularly applies to elderly patients who often have multiple chronic diseases and receive a plethora of drugs.
Referanser
1. Spigset O. Interaksjoner. I: Vennerød AM, redaktør. Norsk legemiddelhåndbok for helsepersonell 2001. T11.4; L11.2.Oslo: Foreningen for utgivelse av Norsk legemiddelhåndbok; 2001. p. 1205 – 1315. www.legemiddelhandboka.no
2. Rang HP, Dale MM, Ritter JM. Pharmacology. 4th ed. Edinburgh: Churchill Livingstone; 1999.
3. Oates JA, Wilkinson GR. Principles of Drug Therapy. In: Fauci AS, Braunwald E, Isselbacher KJ, Wilson JD, Martin JB, Kasper DL, et al., editors. Harrison´s Principles of Internal Medicine. New York: McGraw-Hill; 1998. p. 411 – 22.
4. Hersh EV. Adverse drug interactions in dental practice: interactions involving antibiotics. Part II of a series. J Am Dent Assoc 1999; 130 (2): 236 – 51.
5. Gregg CR. Drug interactions and anti-infective therapies. Am J Med 1999; 106 (2): 227 – 37.
6. Olkkola KT, Backman JT, Neuvonen PJ. Midazolam should be avoided in patients receiving the systemic antimycotics ketoconazole or itraconazole. Clin Pharmacol Ther 1994; 55 (5): 481 – 5.
7. Varhe A, Olkkola KT, Neuvonen PJ. Oral triazolam is potentially hazardeous to patients receiving systemic antimycotics ketoconazole or itraconazole. Clin Pharmacol Ther 1994; 56 (6): 601 – 7.
8. Olkkola KT, Aranko K, Luurila H, Hiller A, Saarnivaara L, Himberg JJ, et al. A potentially hazardous interaction between erythromycin and midazolam. Clin Pharmacol Ther 1993; 53 (3): 298 – 305.
9. Gorski JC, Jones DR, Haehner-Daniels BD, Hamman MA, O"Mara EM Jr., Hall SD. The contribution of intestinal and hepatic CYP3A to the interaction between midazolam and clarithromycin. Clin Pharmacol Ther 1998; 64 (2): 133 – 43.
10. Venkatakrishnan K, von Moltke LL, Greenblatt DJ. Effects of the antifungal agents on oxidative drug metabolism: clinical relevance. Clin Pharmacokinet 2000; 38 (2): 111 – 80.
11. Ezsias A, Wojnarowska F, Juniper R. Topical use of miconazole antifungal oral gel on warfarinized patients: a word of caution. Dent Update 1997; 24 (10): 421 – 2.
12. Pemberton MN, Sloan P, Ariyaratnam S, Thakker NS, Thornhill MH. Derangement of warfarin anticoagulation by miconazole oral gel. Br Dent J 1998; 184 (2): 68 – 9.
13. Munckhof WJ. Concurrent prescribing. Beware of drug interactions. Aust Fam Physician 1998; 27 (10): 895 – 901.
14. Burroughs KE, Chambliss ML. Antibiotics and oral contraceptive failure. Arch Fam Med 2000; 9: 81 – 2.
15. Weisberg E. Interactions between oral contraceptives and antifungals/antibacterials. Is contraceptive failure the result? Clin Pharmacokinet 1999; 36 (5): 309 – 13.
16. ADA Health Foundation Research Institute, Department of Toxicology. Antibiotic interference with oral contraceptives. J Am Dent Assoc 1991; 122 (12): 79.
17. Majerus PW, Broze JGJ, Miletich JP, Tollefsen DM. Anticoagulant, trombolytic, and antiplatelet drugs. In: Hardman JG, Limbird LE, Molinoff PB, Ruddon RW, Goodman Gilman A, editors. Goodman & Gilman´s The Pharmacological basis of Therapeutics. 9th ed New York: McGraw-Hill; 1996. p. 1341 – 59.
18. Cropp JS, Bussey HI. A review of enzyme induction of warfarin metabolism with recommendations for patient management. Pharmacotherapy 1997; 17(5): 917 – 28.
19. Acher GL, Polk RE. Treatment and prophylaxis of bacterial infections. In: Fauci AS, Braunwald E, Isselbacher KJ, Wilson JD, Martin JB, Kasper DL, et al., editors. Harrison´s Principles of Internal Medicine. New York: McGraw-Hill; 1998. p. 856 – 69.
20. Yagiela JA, Picozzi A. General mechanisms of drug interactions. In: Yagiela JA, Neidle EN, Dowd FJ, editors. Pharmacology and Therapeutics for Dentistry. 4th ed. St. Louis: Mosby; 1998. p. 61 – 8.
22. Lunde PKM, Jacobsen D. Medikamentelle bivirkninger og interaksjoner. I: Jacobsen D, Vennerød AM, redaktører. Farmakoterapi for helsepersonell. Oslo: Ad Notam Gyldendal AS; 1997. p. 69 – 85.
23. Benet LZ, Kroetz DL, Sheiner LB. Pharmacokinetics. The dynamics of drug absorption, distribution and elimination. In: Hardman JG, Limbird LE, Molinoff RW, Goodman Gilman A, editors. Goodman & Gilman´s The Pharmacological basis of Therapeutics. 9th ed. New York: McGraw-Hill; 1996. p. 3 – 27.
Antibiotika; Infeksjon; Legemidler; Oral Medisin
Adresse: Per Løkken, Det odontologiske fakultet, Postboks 1057 Blindern, NO-0316 Oslo, Norge. E-post: perl@odont.uio.no