Suturmateriale ved oralkirurgiske inngrep
Forfatter
førsteamanuensis, dr.odont. Odontologisk institutt – periodonti, Det odontologiske fakultet, Universitetet i Bergen
Blant norske tannlegar vart det i 2004 brukt litt meir resorberbare (53,5 %) enn ikkje-resorberbare suturar (46,5 %). Polyglaktin (Vicryl®) var den mest brukte resorberbare suturen (94 %), medan silke hadde nesten ein like dominerande posisjon blant ikkje-resorberbare suturar (74 %) (informasjon frå Johnson & Johnson 2005). Ved lukking av kirurgiske så vel som traumatiske sår må ansvarleg operatør gjera eit val i høve til kva suturmateriale, kva nåltype og kva sutureringsteknikk som høver best. Føremålet med suturering er å stabilisere dei replasserte vevslappane og såleis motvirke at dei forskyv seg under den initiale fasen av sårtilhelinga. Det er difor viktig at ein nyttar suturar som ikkje tapar strekkstyrke for tidleg, og at suturmaterialet ikkje induserer vevsreaksjonar som forstyrrar tilhelingsprosessen. Ved suturering blir vevet perforert og dermed påført sekundære sår i eit allereie traumatisert område. Inn- og utstikka representerer dessutan potensielle loci for bakteriell akkumulering og penetrasjon langs suturkanalane. For mange er val av suturmateriale styrt av vane og subjektive krav til enkel brukshandtering. Hovudmålet med denne artikkelen er å omtala og diskutera dei mest vanlege suturtypane, og samstundes peika på kor viktig det er at ein samla biologisk vurdering ligg til grunn for val av suturmateriale ved oralkirurgiske inngrep.
I den tidlege tilhelingsperioden etter eit oralkirurgisk inngrep vil optimal sårstabilisering vera naudsynt for eit godt behandlingsresultat. Men lengda på den aktive stabiliseringsperioden vil variere med storleiken på det kirurgiske inngrepet og etter kva vev som er involvert. Eit periodontalkirurgisk inngrep skil seg frå kirurgi i alveolær mukosa ved at primærsnittet ofte er lagt i inflammert gingiva og ved at vevslappane må tilpassast tenner. Ved primærsnitt i inflammasjonsfri mukosa treng ein ikkje ta omsyn til tilstøytande tenner. Desse fundamentale skilnadene stiller ulike krav til val av suturmateriale og til tidspunkt for suturfjerning. Indikasjonar for bruk av ulike suturar varierer, og det må såleis understrekast at føremålet med denne artikkelen ikkje er å gjera ein kvalitativ rangering, men heller gje nyttig informasjon i høve til eit velfundert biologisk val.
Kirurgisk sårtilheling
Sjølv om sårtilheling er ein nøye styrt biologisk prosess, vil tidspunktet for avslutta tilheling variere med sårtype, sårstorleik og med kva vev som er involvert. Eit incisjonssår tilheler mykje raskare enn til dømes eit eksisjonssår, sidan det første gror ved primær tilheling medan det andre ved sekundær. Dessutan, på grunn av betre kollateral blodforsyning, vil incisjonssår i oralt vev tilhela raskare enn tilsvarande sår i hud. I freistnaden på å skjematisere sårtilhelingsprosessen ved incisjons- eller eksisjonssår, blir forløpet ofte delt inn i tre overlappande tidsfasar (1) (Fig. 1):
Fase 1: Blodstilling og inflammasjonsutvikling (i både tidleg og sein fase)
Fase 2: Danning av granulasjonsvev
Fase 3: Utvikling av vevsmatriks, modning og remodellering av såret
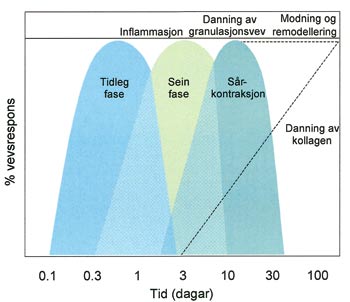
Fig. 1. Skjematisk illustrasjon av dei tre overlappande fasane i sårtilhelingsprosessen ved incisjons- eller eksisjonssår målt som prosent av vevsrespons og med logaritmisk tidsskala.
Alt få minutt etter lukking av såret, blir ytre og indre koaguleringsmekanisme aktivert, og eit blodkoagel fyller spalten mellom sårflatene. Plasmaproteiner, i hovudsak fibrinogen, felles ut i løpet av sekundar på sårflatene og dannar basis for feste av eit fibrinkoagel (2). Levande vev reagerer på alle former for skade med inflammasjon ved å aktivere vaskulære, humorale og cellulære reaksjonsmekanismar på skadeområdet. Denne initiale reaksjonen førebur og påskundar den lokale tilhelinga. Inflammasjons- og tilhelingsprosessen er såleis nøye fletta saman ved at den siste ikkje kan starta før etter oppstarten av den første. All tilheling er avhengig av at inflammasjonsprosessen utviklar eit gunstig miljø for cellulær metabolisme ved å fjerna nekrotisk, øydelagt vev og mikroorganismar. Makrofagar spelar ein nøkkelrolle i inflammasjonsfasen, ikkje berre ved aktiv fagocytose, men også ved frigjeving av biologisk aktive mediatorar som trekkjer til seg andre inflammasjonsceller så vel som fibroblastar og endotelceller. Såleis blir makrofagen også ein viktig faktor i overgangen frå fase 1 til fase 2; frå inflammasjonsutvikling til danning av granulasjonsvev. Ved optimal tilheling er makrofagen den dominerande inflammasjonscella alt etter 12 timar (2).
Innvekst av fibroblastar og utvikling av nye kapillær markerar starten på granulasjonsvevsfasen omlag to dagar etter utført kirurgi (1, 2). Fibroblastane er ansvarlege for produksjonen av kollagenmatriks, fibronektin og proteoglykanar. Granulasjonsfasen går gradvis over i den siste fasen av tilhelinga ved at nydanna, cellerikt vev modnast vidare og blir remodellert i tråd med dei funksjonelle vevskrava. Denne siste fasen kan i tid strekkja seg over fleire månader og i ekstreme situasjonar over år (1).
Ved kirurgi i alveolær mukosa skjer sårtilhelinga svært raskt. Ikkje-kollagene proteinar som glykosaminoglykans, glykoproteinar og myoblastfibronektin dannar eit nettverk på tvers av sårflatene som gjev ein overraskande sterk barriere mot lappforskyving alt etter 48 timar (3). Desse vevsproteinene spelar såleis ei hovudrolle ved utvikling av tidleg sårstyrke etter incisjonar i alveolær mukosa.
I hud spelar epidermis ei tilsvarande viktig rolle for tidleg sårstyrke ved at epitelceller dannar bruer over incisjonssåret og bind dermed saman sårflatene (4). Ikkje-kollagene proteinar har såleis også i hud hovudansvaret for utvikling av tidleg sårstyrke. Men i orale vev skjer tilhelinga i eit mykje raskare tempo enn i hud.
Periodontal kirurgi blir ofte utført i infisert vev med mange intrasulkulære bakteriar. Ved lukking, blir lappane lagt mot avaskulære, kalsifiserte rotflater i ein transgingival posisjon. Medan granulasjonsvevsfasen startar etter om lag to dagar ved incisjon i mukosa og hud, er ikkje granulasjonsvevet mikroskopisk påviseleg i den dento-gingivale interfasen før etter tre dagar (2). Først sju dagar etter sårlukking kan ein sjå eit cellerikt granulasjonsvev med fibroblastar og spor av umodne kollagene fibrar. Ved dette stadiet i tilhelinga er dei kollagene fibrane orientert parallelt med dentinoverflata. I perioden frå sju til 14 dagar tar dei kollagene fibrane til å vise ein meir perpendikulær orientering, og dette indikerer fysisk feste til dentinet (2, 5). Tilstrekkeleg motstand mot drag og separasjonskrefter synes i hovudsak å vera avhengig av etablering og modning av kollagene fibrar på tvers av incisjonssåret og mot rotoverflata. Denne skilnaden i sårtilheling gjer at ved periodontal kirurgi må det stillast heilt spesielle krav til val av suturmateriale og til aktiv funksjonstid for suturane.
Suturmateriale
Alt lenge før Kristi fødsel brukte egyptarane lin til å lukke kirurgiske sår. Seinare vart utvalet utvida med jarn-, gull- og sølvtråd, tørka tarm, hestehår og silke. Fram mot 1930-åra dominerte catgut og silke. Etter andre verdskrigen kom syntetiske ikkje-resorberbare suturar som nylon og polyester, og etter 1970 dei resorberbare syntetiske suturmateriale som Dexon® og Vicryl® (1).
Alle suturar kan delast inn i hovudkategoriane resorberbare eller ikkje-resorberbare suturar laga av naturlege eller syntetiske materiale (3, 4). Hovudskilnaden mellom dei naturlege og syntetiske resorberbare suturane er at dei naturlege vert degradert via enzymatisk proteolyse, medan dei syntetiske vert oppløyst ved vevsvæskehydrolyse (Tabell 1).
Resorberbare suturar |
Ikkje-resorberbare suturar |
||
|---|---|---|---|
Naturlege |
Syntetiske |
Naturlege |
Syntetiske |
Catgut |
Polyglykolsyre (PGA) (Dexon®) |
Silke |
Polyamid (Nylon) |
Kollagen |
Polyglaktin (Vicryl®) (glykolid-laktid copolymer) |
Lin/Bomull |
Polyester (Mersilen®: Polyetylen) Polypropylen (Prolene®) Polytetrafluoroetylen (Gore-Tex®) |
Enkelte av materiala er tilgjengelege berre i monofilamentær form (catgut, kollagen og polypropylen), andre berre som fletta, multifilamentære suturar (silke, Dexon® og Vicryl®), medan andre kan finnast i begge former (nylon og polyester) (6).
Kjemiske og fysiske eigenskapar
Resorberbare suturar
Catgut (Fig. 2): Hovudkomponenten i gut eller catgut er kollagen fra submukosa i saue- eller kvegtarm (3, 4). Kollagenet blir først behandla med fortynna formaldehyd for å auke strekkstyrken og motstanden mot enzymatisk nedbryting. Suturen har monofilamentær form og er i oralt miljø rapportert å bli resorbert i løpet av 3 – 8 dagar. Eventuell kromatisering har til føremål å auka strekkstyrken og å forlenga resorpsjonstida. Dette suturmaterialet er på veg ut av marknaden.
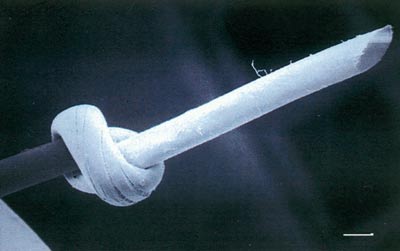
Fig. 2. Sveip-elektronmikroskopisk bilde av ein monofilamentær catgutsutur (stolpe = 0,05 mm).
Polyglykolsyre (PGA) eller Dexon®: Dexon® var den første syntetisk produserte resorberbare suturen (1971) og ligg føre i fletta, multifilamentær form.
Polyglaktin 910 eller Vicryl® (Fig. 3): Denne syntetisk produserte resorberbare suturen er ein glykolid-laktid copolymer av mjølkesyre og glykolsyre, og har ein fletta, multifilamentær form.

Fig. 3. Sveip-elektronmikroskopisk bilde av ein multifilamentær Vicryl®-sutur (stolpe = 0,05 mm).
Ikkje-resorberbare suturar
Silke (Fig. 4): Dei naturleg produserte silkefibrene består av to triangulære fibroin protein-filament som er bundne saman med sericin. Suturen er ikkje-resorberbar og har ein fletta, multifilamentær form (3, 4).
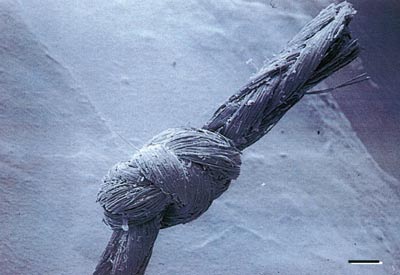
Fig. 4. Sveip-elektronmikroskopisk bilde av ein multifilamentær silkesutur (stolpe = 0,05 mm). (frå ref. 12).
Nylon: Denne syntetisk produserte ikkje-resorberbare suturen er laga av polyamid, og kan ha både mono- og multifilamentær form (3, 4).
Polytetrafluoroetylen eller Gore-Tex® (Fig. 5): Dette er ein syntetisk sutur som er laga av ekspandert polytetrafluoroetylen (ePTFE) polymer eller andre karbon-fluor-samansetningar. Suturen har ein monofilamentær form (7).
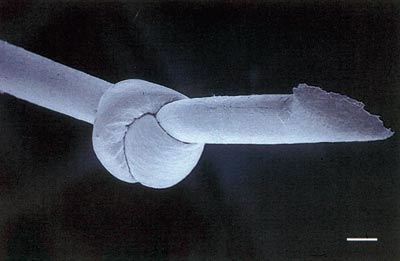
Fig. 5. Sveip-elektronmikroskopisk bilde av ein monofilamentær Gore-Tex®-sutur (stolpe = 0,05 mm). (frå ref. 12).
Biologiske eigenskapar
Suturering påfører tilstøytande sårflater multiple longitudinelle sårperforasjonar. Innstikket og utstikket ville tilhelt på same måte som eit incisjonssår dersom ikkje suturmaterialet med overlegg vert liggjande att i såret. Ved inn- og utstikket skjer det ein sårrespons ved at epitelcellene i sårflatene reagerer på same måte som ved incisjonssår, med migrasjon mot midten av såret. Men i dette høvet migrerar epitelet langs suturen mot bindevevet og vil dermed kunna epitelialisera heile suturkanalen.
Fjerning av suturen vil i dei aller fleste høve riva med seg store deler av det perisuturale epitellaget slik at bindevevstilhelinga kan halda fram, og berre unntaksvis etterlate seg attverande epiteløyar. Har modninga av epitelet nådd full keratinisering, og dersom store deler av keratinet blir liggjande att i bindevevet, kan det oppstå ein intens lokalisert inflammatorisk og immunologisk vevsreaksjon med påfølgjande vevsnekrose (3). Reaksjonen kan lett bli feildiagnostisert som ein suturabscess (3).
Biologiske reaksjonar på ulike suturmateriale er undersøkt, men først og fremst utanfor det orale miljøet (6, 8). Suturbitar av ulik lengde er implantert subkutant, intramuskulært eller i abdominalveggen på ulike forsøksdyr under sterile forhold eller med ei kontrollert mengd bakteriar. Publiserte resultat frå slike standardiserte modellar har demonstrert skilnader i vevsreaksjon mellom dei ulike suturmateriala og mellom dei ulike suturkategoriane. Men ein skal vera svært varsam med å ekstrapolere desse resultata til også å gjelde oralt; eit miljø karakterisert av stor grad av fukt og eit stort innhald av bakteriar. Generelt er det gjort svært få studiar på ulike suturmateriale i munnhola, og mest ingen på humant materiale. Dei få undersøkingane som er utførte konkluderer med at monofilamentære suturar som gruppe er assosiert med mindre grad av vevsrespons enn multifilamentære (9). Enkelte studiar konkluderer med at silkesuturar er årsak til meir uttalt og forlenga inflammatorisk reaksjon både i gingiva og i oral mukosa enn syntetiske suturmateriale (10), medan andre studiar har funne liten skilnad (11). Eit særtrekk ved fleire av desse studiane er at vevresponsen både i mukosa og i gingiva er vurdert med til dels svært grove kliniske mål (9). På bakgrunn av denne mangelfulle og ofte sprikande datamengda, var det vårt mål å undersøkje orale vevsreaksjonar på ulike suturmateriale meir systematisk.
Eigne studiar
I ein studie vart to ulike suturmateriale, silke (fletta, multifilamentær) og Gore-tex® (monofilamentær), plassert i gingiva på seks beaglehundar (12). Alle suturane vart plasserte i underkjeven etter eit «split-mouth» designmønster. Desse suturtypane har overlappande indikasjonsområde slik at ein inngåande vurdering og samanlikning har klinisk verde. Vevsbiopsiar med sutur vart tatt etter tre, sju og 14 dagar. For tre av hundane vart det under heile forsøket gjennomført systemisk og lokal plakk-kontroll, medan for dei tre andre gjekk forsøket utan nokon form for plakk-kontroll.
Eit oversiktsbilde av ein suturbiopsi er vist i Fig. 6. Det histologiske bildet viser ein Gore-Tex®-sutur (S) omgitt av ei sone med biofilm (B) og meir perifert av epitel (E) og bindevev (BV) med varierande grad av inflammasjonsceller. Generelt viste denne studien at alt etter tre dagar hadde epitelet omslutta dei fleste suturane og at epitelarealet auka over tid for begge suturmateriala. Talet på inflammasjonsceller rundt suturen auka også over tid og auken var særleg uttalt for silkesuturar utan plakk-kontroll. Bakterieinnvekst langs suturkanalen vart registrert i seks av ni silkesuturar og i ingen av ni Gore-Tex®-suturar med plakk-kontroll, medan utan plakk-kontroll viste alle silkesuturane og halvparten av Gore-Tex®-suturane plakkinnvekst. Ein viktig skilnad var dessutan at medan bakteriane rundt Gore-Tex®-suturane i hovudsak låg i ei smal sone perisuturalt (Fig. 7), var det bakteriar både rundt og mellom fibrane i silkesuturen (Figs. 8).
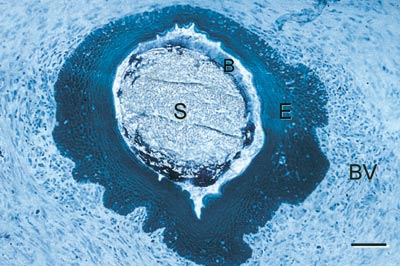
Fig. 6. Gore-Tex®-sutur (S) sentralt med biofilm (B), gingivalt epitel (E) og bindevev (BV) meir perifert (farge: toluidin-blå; stolpe = 0,2 mm). (frå ref. 12).
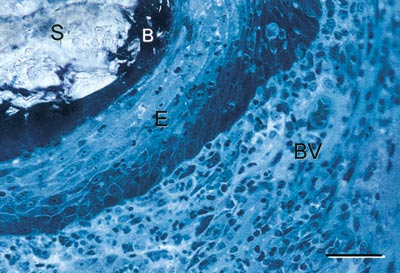
Fig. 7. Gore-Tex®-sutur (S) sju dagar etter plassering. Biofilmen (B) ligg perisuturalt. Det histologiske snittet viser inflammasjonsceller i epitel og bindevev (farge: toluidin-blå; stolpe = 0,1 mm). (frå ref. 12).
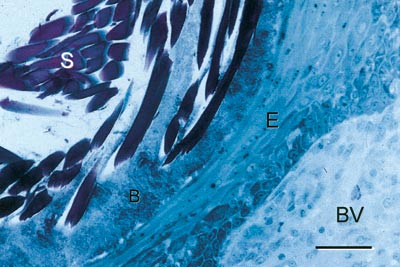
Fig. 8. Silkesutur (S) sju dagar etter plassering med biofilm både perisuturalt og mellom silkefibrane (farge: toluidin-blå; stolpe = 0,1 mm). (frå ref. 12).
Hovudkonklusjonen frå denne studien er at suturar i oralt vev framkallar inflammatoriske reaksjonar uavhengig av plakk-kontroll og at reaksjonen er meir uttalt rundt silke enn Gore-Tex®.
I eit anna forsøk vart fire ulike suturmateriale plassert i gingiva og orale mukosa på ni beaglehundar (13). Krava til dei fire inkluderte suturane var at dei skulle vera vanlege i klinisk bruk og vera frå begge hovudgruppene resorberbare og ikkje-resorberbare, og i tillegg vera i likt antal frå suturkategoriane fletta, multifilamentær og monofilamentær. Tre, sju og 14 dagar etter plassering, vart det tatt biopsiar med catgut-, Vicryl®-, silke- og Gore-tex®suturar og desse vart analysert histologisk. I heile forsøksperioden vart det utført plakk-kontroll med 0,2 % klorheksidinspray. Inflammasjonsgraden rundt kvar enkel sutur vart gradert ved å måla diameteren på hevinga på fargeslides tatt like før avliving.
Generelt viste denne undersøkinga at inflammasjonsreaksjonen rundt oralt plasserte suturar utvikla seg raskare og var meir intens enn tilsvarande rapporterte forandringar etter plassering i hud (Fig. 9). Bakteriell invasjon av suturkanalen var eit vanleg funn uavhengig av suturmateriale, men var særleg uttalt for silke. Mange av silkesuturane vart dessutan sekvestrert alt etter sju dagar slik at resultatet for silke eigentleg var verre enn det som kom fram i analysane. Den perisuturale epitelialiseringen starta alt etter tre dagar, og for enkelte preparat var den fullstendig ved 14 dagar og omfatta då heile suturforløpet. Fleire catgutsuturar var borte alt ved tre dagar, og ingen kunne sjåast klinisk etter sju dagar (Fig. 9).
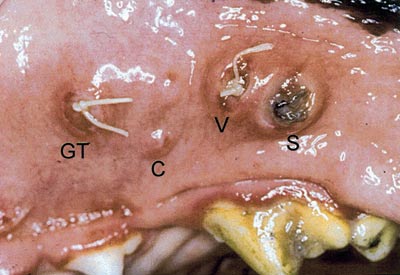
Fig. 9. Sju dagar etter plassering av Gore-Tex® (GT), Catgut (C), Vicryl (V) og silkesutur (S) i mukosa på hund. Catgut er alt mista, men innstikket og utstikket er framleis synleg. Klinisk ser ein meir vevsreaksjonar og plakk rundt silkesuturen enn rundt Gore-Tex®- og Vicryl®-suturane. (frå ref. 13).
Med dette studiedesignet var det også mogeleg å samanlikna skilnader mellom ulike suturkategoriar. Resultata stadfestar tidlegare rapporterte funn at fletta, multifilamentære suturar framkallar større grad av inflammasjon og gjev meir bakteriell innvekst langs suturkanalen enn monofilamentære suturar.
Alt få dagar etter lappoperasjon rundt 35, 36 har suturane losna og står passivt i vevet utan stabiliserande funksjon (Fig. 10). Denne uheldige kliniske situasjonen er ikkje uvanleg. Mest truleg har den postoperative hevinga ført til vevssprenging med påfølgjande tap av funksjon, eller det kan ha skjedd ein rein sequestrering av suturen. I den neste studien på 12 pasientar med bilaterale periodontale defektar i overkjeven ønskja ein å testa om det var skilnad i graden av losning mellom ulike suturmateriale (14). På kvar pasient vart det sett ein Gore-Tex® og ein silkesutur 10 dagar før avtalt gingivektomi og eit anna par tilsvarande suturar sju dagar før kirurgi. Etter plassering vart lengda på suturen i vevet så vel som slakken på suturløkka målt. Desse målingane vart gjort på nytt ved gingivektomitidspunktet. Vevsbiopsien med suturen på plass vart så grovdissekert og gjort klar for histologisk framstilling.
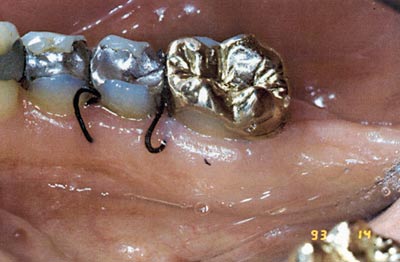
Fig. 10. Passive suturar rundt 35 utan stabiliserande effekt (sju dagar postoperativt).
Denne studien viste at silkesuturar losnar i signifikant større grad enn Gore-Tex®-suturar og har såleis ein dårlegare sårstabiliserande effekt. Vevsanalysen viste dessutan ein meir uttalt inflammasjonsreaksjon rundt silkesuturar og større innvekst av bakteriar.
Konklusjonar
Utgangspunktet for alle oralkirurgiske inngrep er at suturar skal fjernast så raskt som mogeleg ved tilstrekkeleg sårstyrke for å unngå full epitelialisering av suturkanalen. Ved incisjonar i alveolær mukosa utviklar ikkje-kollagene protein ein betydeleg bruddstyrke svært tidleg, slik at suturfjerning av ikkje-resorberbare suturar kan skje alt etter 3 – 5 dagar. Av dei resorberbare suturane, synest catgut å vera mest eigna ved slik kirurgi, sidan aktiv funksjonstid er omlag 3 – 5 dagar. Andre resorberbare suturar blir i vevet lenger enn naudsynt.
Ved periodontal kirurgi er sårstyrken avhengig av styrken til kollagene fibre som blir etablert på tvers av incisjonssåret, og denne prosessen startar først etter sju dagar. Postoperativt vil såleis ideell tid for suturfjerning vera etter 10 – 12 dagar. I klartekst tyder dette at catgut er ueigna ved periodontal kirurgi. Kravet til lang funksjonstid, samt uttalt innvekst av bakteriar langs suturkanalen og sterke inflammatoriske vevsreaksjonar, indikerar at også silkesuturar er lite egna ved periodontalkirurgiske inngrep. Det høge talet av sekvestrerte silkesuturar alt etter sju dagar, støttar denne konklusjonen. Generelt synest multifilamentære suturmateriale å gje større grad av vevsreaksjonar enn tilsvarande monofilamentære og då særleg ved usikker plakk-kontroll.
Eit velfundert suturval ved oralkirurgiske inngrep er viktig, men framleis vil den største utfordringa liggje i å redusere omfanget av det kirurgiske traumet ved å utøve varsam vevshandtering.
English summary
Leknes KN.
Suture materials in oral surgical procedures
828 – 33.
A variety of suture materials are in current use to close incisional, excisional, as well as traumatic wounds in the oral cavity. Generally, sutures are placed to stabilize detached tissue flaps during initial phases of the wound healing process. An ideal suture should be biocompatible, easy to handle, cause minimum tissue reactions and have low cost. By placing sutures the already traumatized tissues are perforated and thereby exposed to new micro wounds. The entrance as well as the exit sites represent a potential locus for bacterial accumulation and penetration along the suture track. Preference of suture materials is by and large dictated by tradition and for ease in handling. The purpose of the present paper is to describe and discuss the most common suture materials on the market, with particular emphasis on chemical, physical and biological factors when placing a suture. Several studies have demonstrated that placement of sutures in gingival tissues elicits an inflammatory reaction and that the magnitude of this reaction may vary with the suture material. Braided silk sutures apparently cause a more extensive inflammatory tissue reaction in an environment characterized by moisture and infectious potential.
Hovudbodskap | |
|---|---|
• |
Etter oralkirurgiske inngrep må replasserte vevslappar stabiliserast med suturar. Det er difor viktig at suturmaterialet ikkje induserar vevsreaksjonar som forstyrrar tilheldingsprosessen |
• |
Suturar i oralt vev framkallar varierande grad av inflammatoriske reaksjonar. Ein samla biologisk vurdering må liggja til grunn for val av suturmateriale |
• |
Suturar utan stabiliserande effekt skal fjernast så raskt som mogeleg |
• |
Generelt induserer multifilamentære suturmateriale større grad av vevsreaksjonar og meir innvekst av bakteriar enn tilsvarande monofilamentære |
Referansar
1. Clark RAF. Wound repair. Overview and general consideration. In: Clark RAF, Henson PF, editor. The molecular and cellular biology of wound repair. 2. ed. New York: Plenum Press; 1996: p. 3 – 50.
2. Wikesjö UME, Nilveus RE, Selvig KA. Significance of early healing events on periodontal repair. A review. J Periodontol 1992; 63: 158 – 65.
3. Gutmann JL, Harrison JW. Surgical Endodontics. Boston: Blackwell Scientific; 1991: 278 – 99.
4. Cohen ES. Atlas of cosmetic and reconstructive periodontal surgery. 2. ed. Philadelphia: Lea & Febiger; 1994: p. 9 – 30.
5. Sandberg N, Zederfeldt B. The tensile strength of healing wounds and collagen formation in rats and rabbits. Acta Chir Scand 1963; 126: 187 – 96.
6. Ethicon.Wound Closure Manual. http://www.jnjgateway.com/public/USENG/Ethicon _ WCM_Feb 2004.
7. La Scala G, Zleo M. Sutures in dentistry. Traditional and PTFE materials. Dent Cadmos 1990; 58: 54 – 9.
8. Garrett AB. Wound closure materials. In: Wheeland RG, editor. Cutaneous Surgery. Philadelphia: WB Saunders; 1994; p. 199 – 205.
9. Lilly GE. Reaction of oral tissues to suture materials. Oral Surg Oral Med Oral Pathol 1968; 26: 128 – 33.
10. Abi Rached RSG, de Toledo BEC, Okamoto T, Marcantonio E Jr, Sampaio JEC, Orrico SRP, Marcantonio RAC. Reaction of the human gingival tissue to different suture materials used in periodontal surgery. Braz Dent J 1991; 2: 103 – 1.
11. Bergenholtz A, Isaksson B. Tissue reactions in the oral mucosa to catgut, silk, and Mersilene sutures. Odontol Revy 1967; 3: 237 – 50.
12. Leknes KN, Selvig KA, Bøe OE, Wikesjö UME. Tissue reactions to sutures in the presence and absence of anti-infective therapy. J Clin Periodontol 2005; 32: 130 – 8.
13. Selvig KA, Biagiotti GR, Leknes KN, Wikesjö UME. Oral tissue reactions to suture materials. Int J Periodont Rest Dent 1998; 18: 475 – 87.
14. Leknes KN, Røynstrand IT, Selvig KA. Human gingival tissue reactions to silk and expanded polytetrafluoroethylene sutures. J Periodontol 2005; 76: 34 – 42.
Adresse: Knut N. Leknes, Det odontologiske fakultet, Årstadveien 17, 5009 Bergen. E-post: knut.leknes@odont.uib.no
Artikkelen har gjennomgått ekstern faglig vurdering.