Periodontal mikroflora – fra spesifisitet til kompleksitet
Bakterier som etiologisk faktor til periodontale sykdommer har vært et sentralt tema for odontologisk forskning i mer enn hundre år. Forskningen og hypotesene relatert til periodontal sykdomsutvikling har forandret seg i takt med utviklingen av nye forskningsteknikker. Interessen for den periodontale bakteriefloraen har gjennom historien hatt en syklisk natur. Dette har resultert i mange forsinkelser på veien mot en forståelse av det komplekse subgingivale mikrobielle samfunn.
Vi ser i dag et sammensatt bilde av mange etiologiske faktorer involvert i utviklingen av periodontale sykdommer, og basert på den mengden data vi finner i litteraturen, er det etablert en bred enighet om at bakterier har en av primærrollene i utviklingen av periodontitt. Det er derfor høyst relevant å inkludere fortiden i fremtidens forskning for å hindre avsporinger i søk etter svar på mikroorganismenes rolle ved periodontale sykdommer. Betydningen av nye forskningsteknikker ble tydelig demonstrert med Antonie van Leeuwenhoeks konstruksjon av det første mikroskopet. Med plakk fra tenner ble de første bakterier beskrevet i detalj fra mikroskopet, og resultatene ble publisert i et brev til The Royal Society i London i 1683 (1). Med utviklingen av mikroskopet åpnet det seg en helt ny verden av kunnskap. Et av de første spesifikke navn på periodontale sykdommer i litteraturen er Pierre Fauchards «Scurvy of the gums», som han beskrev i sin bok «Le chirurgien-dentiste» fra 1728 (2).
Skjørbuk er som kjent en mangelsykdom forårsaket av lave nivåer av vitamin C. Det er lett å forstå assosiasjonen til periodontitt med kliniske symptomer som blødninger, oppsvulmet og blodig tannkjøtt, dårlig appetitt og vekttap. Oppdagelsen av orale bakterier førte forskerne til spekulasjoner rundt en kompleks etiologi knyttet til infeksiøse orale sykdommer. Den britiske legen John Hunter beskrev gingivitt og pyorrhea in sin bok «The natural history of the human teeth» (3) i 1771 og erklærte at de orale infeksiøse sykdommene også kan fungere som kilde til infeksjoner andre steder i kroppen. En av studentene til den legendariske mikrobiologen Robert Koch, W.D. Miller, publiserte sitt arbeid «The microorganisms of the human mouth» (4) i 1890. Miller beskrev bakterier assosiert med bløtvevssykdommer uten at han kunne finne en spesifikk bakterie som forårsaket pyorrhea alveolaris. Basert på disse observasjonene spekulerte han i en multifaktoriell etiologi for periodontale sykdommer.
Mikrobiologiens gylne tidsalder
Perioden 1880 – 1930 er ofte omtalt som mikrobiologiens gylne tidsalder. I arbeidet med å finne etiologiske agens til mange sentrale medisinske infeksjoner ble mange bakterier oppdaget og knyttet til spesifikke sykdommer (Figur 1. A). Ett flott eksempel er Armauer Hansens oppdagelse av leprabasillen i 1873 i Bergen (5). Det er derfor ikke overraskende å finne parallelle undersøkelser fra denne tiden med fokus på bakteriell etiologi ved periodontale sykdommer. I perioden 1880 – 1930 ble fire grupper av mikroorganismer regnet som mulige etiologiske agens for periodontitt; amøber, spiroketer, streptokokker og fusiforme bakterier (6). Identifiseringen av disse organismene var påvirket av hvilke teknikker som var tilgjengelige på denne tiden. Teknikkene bestod av å måle vekten av fuktig plakk, farging og påfølgende undersøkelse under mikroskopet, samt begrensede teknikker for dyrkning. I løpet av perioden 1900 – 30 ble det vanlig for leger og tannleger å benytte vaksiner for kontroll av bakterielle infeksjoner. For behandlingen av periodontale sykdommer ble det utviklet tre ulike vaksiner. Det var vaksiner fra ren bakteriekultur (7), autogene- og polyvalente vaksiner som Van Cotts, Goldenbergs og Inava Endocorps vaksine (8). Inava Endocorps vaksine var laget av en blanding av syv organismer som inkluderte Staphylococcus aureus, Escherichia coli og Klebsiella pneumoniae (9). Autogene vaksiner var fremstilt av dentalt plakk fra pasientene selv. Plakket ble sterilisert ved hjelp av varme og/eller ved overføring til jod/formalinløsninger for så å bli injisert tilbake inn i den samme pasienten, enten lokalt i periodontalt vev eller systemisk (10).
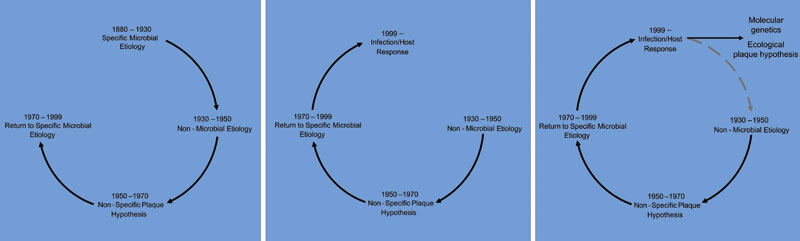
Figur 1 A–C: Interessen for den periodontale bakteriefloraen som etiologisk faktor til periodontitt har gjennom historien hatt en syklisk natur. Forskning og klinisk behandling har hatt et skiftende fokus på henholdsvis den antatte spesifikke og den uspesifikke bakteriefloraen. Angitte tidsperioder representerer ulik forståelse av etiologien knyttet til periodontale sykdommer.
Alternativ etiologi
I 1925 introduserte McCall og Box (11) uttrykket periodontitt, som inkluderte inflammatoriske sykdommer som påvirker gingiva, periodontalligamentet og alveolart ben. Videre delte forfatterne periodontitt inn i to undergrupper, simpleks og kompleks. Simpleks var forårsaket av lokale etiologiske faktorer mens kompleks var et antatt resultat av systemiske faktorer. I samme år kom teorien om at bakterier kan invadere periodontalt vev og dermed spille en viktig rolle i patogenesen til periodontale sykdommer. Med biopsier fra fanger i San Qentin State Prison, California, kunne Beckwith og medarbeidere (12) vise bakterier i epitelet og underliggende vev ved hjelp av farging. Bakterier påvist i epitelet var vanligvis streptokokker, og i underliggende vev ble det identifisert gram-negative staver. Spiroketer ble ved sjeldne tilfeller også identifisert i vev. I samme tidsperiode utførte Daley (13) sin kjente studie rettet mot forekomst av akutt nekrotiserende ulcerativ gingivitt (ANUG). Det ble diagnostisert ANUG (Vincents infeksjon) hos 1/3 av de tusen individene som deltok fra Boston-området. Daley beskriver tilstanden i detalj, slik vi kjenner den i dag, og søker etter tilstedeværelse av fusiforme bakterier og spiroketer. Utbrudd av ANUG under og etter første verdenskrig hadde en epidemisk natur, hvor utbredelsen av tilstanden og spredningen av periodontale patogene bakterier var antatt overført fra en person til en annen. Det ble i denne tidsperioden presentert fire forskjellige mikrobegrupper som etiologiske agenter for periodontal sykdom.
Et naturlig mål for behandlingen på denne tiden inkluderte mikrobiell kontroll. Til tross for funnene av orale bakterier i periodontalt vev var interessen avtagende for en infeksiøs årsak ved periodontale sykdommer på slutten av 1920-tallet. Klinikerne gjorde gode terapivalg, og påfølgende behandling gav eliminasjon av de etiologiske agens, men utviklingen av periodontitt stoppet ikke hos pasientene. Konkurrerende teorier om etiologien til periodontale sykdommer hadde derfor voksende popularitet. Fra midten av 1920-årene og i de neste to tiårene var periodontale sykdommer forbundet med alternative hypoteser. Gottlieb var den første forfatteren som skilte mellom ulike former for periodontale sykdommer (14). En klassifikasjon var basert på tre publikasjoner fra 1920-tallet (9), hvor det ble definert fire typer av periodontitt; medfødte defekter hos pasientene, traumer fra okklusjonen, diffus alveolar atrofi eller vedvarende erupsjon av tenner. Bakterier ble ikke ansett å ha en sentral rolle ved periodontal destruksjon, den ble derimot assosiert med sekundære infeksjoner (14). En enighet om en ny etiologi ledet til nye klassifikasjoner. I 1931 skiller Becks mellom paradentitt og genuin paradentose (15). Paradentitt oppstod angivelig fra gingiva i form av gingivitt og paradentosis hadde utspring fra alveolart ben i form av osteopati. Orban og Weinmann (16) adopterte denne nomenklaturen og benyttet uttrykket periodontosis for å betegne denne ikke-inflammatoriske sykdommen. Periodontosis var forskjellig fra periodontitt, som var antatt å være en følge av gingivitt og derfor av inflammatorisk opprinnelse.
«Plakkevangelistene»
Etter en periode (1930 – 50) med fokus på alternative etiologiske faktorer til periodontitt, retter en gruppe klinikere, ofte referert til som «plakkevangelistene», oppmerksomheten mot betydningen av plakkontroll i behandlingen (Figur 1. A). Jens Wærhaug deler denne overbevisningen, og det fokuseres på plakkontroll i profylakse og behandling av periodontitt. På nytt er bakteriene antatt å spille en viktig rolle i etiologien, men i uspesifikke roller. Den uspesifikke plakkhypotesen hevder at sykdom er et resultat av den totale mikrofloraen i plakk, der bakteriene kun er tiltenkt ulike egenskaper i form av virulensfaktorer som forårsaker sykdom. Plakk vil forårsake sykdom uavhengig av sammensetningen av bakterier fordi det er kvantiteten og ikke kvaliteten som er viktig. Hypotesen blir støttet av ulike studier (17), og i 1956 benytter MacDonald og medarbeidere (18) resultatene av sine studier på sammensatte infeksjoner i dyremodeller til å proklamere; «Periodontale sykdommer – bakteriologisk uspesifikke, men biokjemisk spesifikke». Sammenhengen mellom plakk og gingival inflammasjon ble demonstrert i de historiske publikasjonene om eksperimentell gingivitt av Løe og samarbeidspartnere i 1965 og 1966 (19, 20).
Spesifikk mikrobiell etiologi
Fra 1970 vender forskningen tilbake til en overbevisning om bakteriell spesifisitet i etiologien til periodontale sykdommer (Figur 1. B). I mange observasjoner på denne tiden ble spiroketer isolert fra pasienter med ANUG (21). Klassiske studier av Slots, Tanner og Newman med samarbeidspartnere (22 – 24), demonstrerte at mikrobiell sammensetning i subgingivalt plakk ved friske forhold, juvenil periodontitt og periodontitt hos voksne var forskjellig. Det stadig voksende antall studier som refererte til en spesifikk mikroflora knyttet til spesifikke forhold, dannet bakgrunnen for utformingen av en ny plakkhypotese i 1976. Den spesifikke plakkhypotese (25) hevdet at ut i fra en rik samling av ulike bakteriearter som er til stede i plakk, vil kun et fåtall av bakteriene være direkte involvert i sykdomsutvikling. I denne perioden publiseres det et høyt antall artikler basert på deskriptive studier som observerte bakterielle profiler assosiert med spesifikke tilstander i munnhulen. Fra de mange forskningsgruppene som rapporterte fra dyrkningsbaserte studier, utvikles en konsensus om at det finner sted forandringer i den subgingivale mikrofloraen ved utvikling av sykdom. Bakteriefloraen synes å gå fra en dominans av gram-positive streptokokker til en sykdomsrelatert mikroflora dominert av Actinomyces-arter samt en økning i kapnofile og obligat anaerobe bakterier som Capnocytophaga, Fusobacterium og Prevotella.
Mikrobiell diversitet
Med den økende interessen for å beskrive diversiteten i den komplekse orale mikrofloraen, ble det påvist stadig nye bakteriearter. To klassiske studier av Socransky (26) og Moore & Moore (27) illustrerer den orale artsrikdom. I mange år var den vanligste teknikken for identifisering av bakterier dyrkning for artsbestemmelse basert på fenotypiske egenskaper. Teknikkene er ekstremt tidkrevende og dyre. I perioden 1982 – 88 ble 300 prøver av subgingivalt plakk analysert av Socransky-gruppen ved The Forsyth Dental Center i Boston. I denne 6-års perioden ble 15 000 bakterieisolater karakterisert fra 88 personer. I publikasjonen av Socransky (26) fra 1984 estimeres antallet arter i plakk til å være 200 – 300 bakterier. Moore & Moore (27) analyserte sammensetningen av subgingivalt plakk ved friske periodontale forhold og ulike stadier av periodontal sykdom. I denne studien fra 1994 ble 51 000 isolater karakterisert fra 300 individer og 509 ulike bakterier ble identifisert, hvorav 368 bakterier ble påvist mer enn én gang. Det høye antallet bakteriearter påvist i munnhulen demonstrerte artsrike mikrobielle samfunn.
Sammensetningen av mikrofloraen i plakk er forskjellig fra et habitat til et annet, og det finnes forskjeller mellom friske habitater og habitater med sykdom. Når mikrofloraen først er etablert i et sete, er den relativt stabil over tid. Dette fenomenet er blitt beskrevet som bakteriell homeostase (28). Derimot kan store forandringer av miljøfaktorer i det lokale mikrobielle samfunnet resultere i en ny bakteriell sammensetning av mikrofloraen, slik at den kritiske utvikling fra friske forhold til sykdom vil kunne finne sted. Som følge av arbeidet med å forklare forholdet mellom miljøfaktorer som pH, redokspotensial, temperatur, oksygenmetning og forandringer i mikrofloraens sammensetning i ulike habitater, ble den økologiske plakkhypotesen utformet av Marsh i 1991 (28). Denne hypotesen var ment å forklare forskjellene i sammensetning ved de ulike mikrobielle samfunn som representerer friske forhold og sykdom i munnhulen.
Mikrofloraen ved karies og periodontitt kan benyttes som eksempler på dette. Bakteriene som utgjør mikrofloraen ved periodontitt har egenskaper til å takle pH-verdier høyere enn syv. For bakteriene i den periodontale lommen er proteiner den viktigste næringskilden, derav bakterienes proteolytiske natur. Ved karies må bakteriene ha nødvendige egenskaper for omstilling ved pH-fall. Karbohydrater i saliva er den viktigste næringskilden for supragingivale bakterier, som igjen favoriserer bakterier med nødvendige egenskaper til å bryte ned karbohydrater. Med forståelsen av den økologiske plakkhypotesen synes det lokale miljøet å diktere hvilke mikrobielle egenskaper som kreves av mikrobene i miljøet i et habitat. Dette vil videre bestemme sammensetningen av mikrofloraen ved ulike tilstander. Miljøet gir bakterier med visse egenskaper kvalitative fordeler til etablering i et habitat der mange faktorer er tett relatert til symbiosen mellom verten og mikrofloraen.
Klassifikasjonen av 1999
Fra 1970-tallet startet utviklingen av et nytt syn på etiologien til periodontale sykdommer som omhandlet samhandlingen mellom mikrobiell infeksjon og respons fra verten. En ny klassifikasjon av periodontale sykdommer ble laget i 1989 og senere modifisert i 1999 (29). Den gjeldende klassifikasjonen fra 1999 er basert på nettopp relasjonen mellom infeksjon og vertens respons. Klassifikasjonen inneholder åtte hovedgrupper av diagnoser knyttet til gingivitt og syv hovedgrupper knyttet til periodontitt. Hver av hovedgruppene er videre delt inn i flere undergrupper av diagnoser i et system som synes å være komplisert både i klinikken og i forskningen. Det stilles forventninger til nye definisjoner av periodontitt og en ny klassifikasjon som i fremtiden vil gi en felles og samlende forståelse av periodontitt (30).
Molekylære teknikker
Det er enighet om at bakteriell artsrikdom i et gitt miljø er alvorlig underestimert ved analyser basert på dyrkningsbaserte teknikker. Inntil siste tiår var en stor del av kunnskapen relatert til periodontal mikrobiota, ved friske og syke forhold, generert enten av dyrkningsbaserte studier eller av metoder som var basert på dyrkbare bakterier. I nyere tid er det blitt demonstrert høy mikrobiell diversitet. Til tross for vanskelighetene med å katalogisere alle mikroorganismene, samt å bestemme deres patologiske potensial, er det verdt å merke seg at de fleste medlemmene i den orale mikrofloraen er påvist fra periodontale lommer. Mer enn 400 bakteriearter er identifisert fra subgingivale prøver. Molekylærgenetiske teknikker og den økologiske plakkhypotesen synes å ha åpnet et nytt kapittel i forståelsen av bakteriell etiologi knyttet til komplekse orale sykdommer (Figur 1.C).
Socransky-studiene
Det er gjennom årene publisert et stort materiale i mange gode deskriptive studier vedrørende artsrikdom knyttet til diagnosen periodontitt, men vi ønsker å nevne spesielt en forskningsgruppe som har utført et systematisk arbeid over tid for å utrede mikrobiologiens rolle i etiologien til periodontitt. Ved å sammenligne en rik mikrobiell diversitet hos friske individer med tilsvarende diversitet hos syke individer har Sigmund S. Socransky gjennom systematiske studier kartlagt sammensetningen av bakteriekomplekser ved periodontitt. Med bakgrunn i en rekke observasjoner registrerte Socransky at noen arter var til stede i et stort antall ved dype periodontale lommer (Figur 2). Den identifiserte bakteriefloraen ble delt inn i ulike komplekser basert på tilstedeværelse i ulike trinn av sykdomsutvikling. Noen av kompleksene var assosiert med friske forhold og andre var knyttet til sykdom (31). De ulike kompleksene ble tildelt fargekoder der det røde og det orange komplekset er assosiert med sykdom (Figur 2). Neste trinn i arbeidet til Socransky gikk ut på å definere medlemmene i det røde komplekset som periodontale patogener. I dette arbeidet ble postulatene til legendariske Robert Koch modifisert for å kunne definere patogene bakterier som gir utvikling og progresjon av periodontitt. De utvidede kriteriene inneholder krav om assosiasjon, eliminasjon, vertsrespons, virulensfaktorer, dyremodeller og risikovurdering. Tabell 1 viser hvordan Porphyromonas gingivalis er vurdert som en patogen bakterie. Tre periodontale patogener, P. gingivalis, Tannerella forsythia og Treponema denticola, utgjør det røde komplekset.
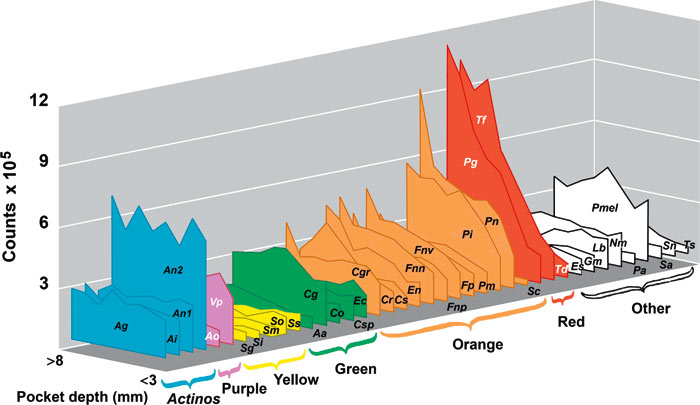
Figur 2. Den dyrkbare periodontale bakteriefloraen er delt inn i ulike bakteriekomplekser av S.S. Socransky (31). Antallet bakterier som ble påvist fra kliniske prøver er gjennom figuren illustrert i relasjon til målte lommedybder. Kompleksene representerer tilstedeværelse ved friske forhold og ved ulike trinn av sykdomsutvikling. Det røde og oransje komplekset er assosiert med sykdom. (Gjengitt med tillatelse, Periodontology 2000).
Assosiasjon |
Økt nivå av bakterien i lesjoner med periodontitt |
Uvanlig forekomst ved friske forhold eller ved gingivitt |
|
Tilstedeværelse på gingivale epitelceller subgingivalt |
|
Eliminasjon |
Eliminasjon resulterer i vellykket terapi |
Refraktære lesjoner inneholder bakterien |
|
Vertsrespons |
Økt nivå av antistoffer i serum hos pasienter med periodontitt |
Økt lokal antistoffrespons mot bakterien hos pasienter med periodontitt |
|
Virulensfaktorer |
Kollagenase, trypsin-lignende aktivitet, fibrinolysin, andre proteaser, fosfolipid A, fosfataser, endotoksin, H2S, NH3, fettsyrer, faktorer som motvirker polymorfonukleære leukocytter (PMNs) |
Dyremodeller |
Viktig rolle i sammensatte infeksjoner |
Studier på aper og hunder |
Socransky har i sine systematiske studier utredet mikrobielle forandringer relatert til konvensjonelle behandlingsstrategier som mekanisk depurasjon, kirurgi og kombinasjoner av antibiotikabehandling. I dette arbeidet har han hatt stor nytte av teknikken DNA-DNA-hybridisering, «checkerboard analysis», som han har tilpasset periodontale prøver. Socransky har i hovedsak benyttet systemet til å teste 40 ulike dyrkbare bakteriearter mot mer enn 150 000 kliniske prøver ved The Forsyth Institute. Det mangler fortsatt svar på mange spørsmål vedrørende rollen til mikrobiologien ved periodontale sykdommer, men det systematiske arbeidet som er utført av Socransky-gruppen har gitt et stort bidrag til forståelsen av mikrobielle aspekter ved komplekse sykdommer. Det er verdt å merke seg at Socransky allerede i en publikasjon fra 1963 anslo at 50 % av mikrofloraen i munnhulen sannsynligvis ikke lot seg dyrke (32). Kunnskap knyttet til den dyrkbare delen av den orale mikrofloraen vil i årene som kommer ha stor betydning for arbeidet med å forstå den ikke dyrkbare delen av den totale mikrofloraen. For å illustrere betydningen av de siste års nye molekylærgenetiske teknikker og diversiteten i den orale mikrofloraen, er det verdt å vise til funnene av Paster og medarbeidere (33) ved å analysere artsrikdom av spiroketen T. denticola, som inngår i det røde komplekset til Socransky (Figur 3).

Figur 3. Artsrikdom av spiroketen T. denticola, som inngår i det røde komplekset, demonstrert ved bruk av dyrkningsuavhengige molekylære teknikker og tilstedeværelse av 16S rRNA-gener i friske og syke periodontale lommer (33). Lengden på 5 %-linjen representerer 5 % genetisk forskjell (nucleotidsekvenser) mellom de ulike bakteriearter eller fylotyper. (Gjengitt med tillatelse, Journal of Clinical Microbiology).
16S rRNA-gener
Innføringen av molekylære teknikker har gitt nye dimensjoner til den orale mikrobielle diversitet. I det røde komplekset til Socransky ble T. denticola fremstilt som en av tre ulike bakteriearter (Figur 2). Paster og medarbeidere (33) viste senere at dette ikke handlet om bare én bakterieart, men identifiserte ved hjelp av molekylære teknikker 54 ulike Treponema-arter eller fylotyper (Figur 3) fra subgingivale prøver (33). Fylogeni kan defineres som den evolusjonære utviklingen og historien til alle arter eller høyere taksonomiske grupperingen av organismer. En fylotype av den orale mikrofloraen er definert som bakterier med mer enn 98 % genetisk likhet i funksjonelle gener som f. eks. 16S rDNA. Ved hjelp av fylogeni kan det fremstilles slektstrær av artene som viser hvor i den evolusjonære utviklingen artene ble separert (34). De genetiske forskjellene i sekvensene av sammenlignbare gener tiltar med økende avstand i slektstreet. 16S rRNA-genet inngår i translasjonsapparatet for proteinsyntesen, og alle bakterier har dette genet. For identifisering av bakterier fra dental biofilm blir DNA fra bakteriene isolert og renset (Figur 4). Ved hjelp av polymerase kjedereaksjon (PCR) kan 16S rRNA-genet på DNA-molekylene kopieres i et stort antall, som er nødvendig for videre analyser. 16S rRNA-genet består av områder som i ulik grad er forskjellig fra en bakterieart til en annen. Enkelte områder har like basesekvenser for alle bakterier mens andre områder kan være helt forskjellige og spesifikke for en enkelt bakterieart. Dette blir utnyttet avhengig av om det er spesifikke bakterier eller grupper av bakterier som skal identifiseres. PCR-teknikken gir flere millioner kopier av de aktuelle 16S rRNA-genene. For sekvensering og identifisering av enkelte bakterierarter, fra et stort antall av 16S rRNA-gener, er det vanlig å benytte kloningsteknikk (Figur 4). Escherichia coli-bakterier, modifisert for dette formålet, har evnen til å ta opp kun ett 16S rRNA-gen per bakterie, slik at hver bakteriekoloni vil representere en bakterieart fra den opprinnelige kliniske prøven. Ved hjelp av sekvensering blir 16S rRNA-genet avlest og basesekvensen kan sammenlignes mot basesekvenser fra registrerte bakterier i internasjonale genbanker. Bakteriene blir på denne måten identifisert basert på sitt DNA, og de nevnte molekylære teknikkene er ikke avhengig av dyrkning. Analyser av mikrobielle samfunn basert på dette genet vil påvise både dyrkbare og ikke dyrkbare arter, og det er ingen begrensninger i kompleksiteten av populasjonen som undersøkes. Det er antatt at mindre enn 2 % av de eksisterende mikroorganismer på jorda er påvist med dyrkningsbaserte teknikker. Identifiseringen av alle medlemmene i mikrofloraen som representerer friske forhold og sykdom er helt nødvendig for å forstå etiologien og utviklingen av infeksjonssykdommer. Det er i dag identifisert 770 arter eller fylotyper fra munnhulen (34).
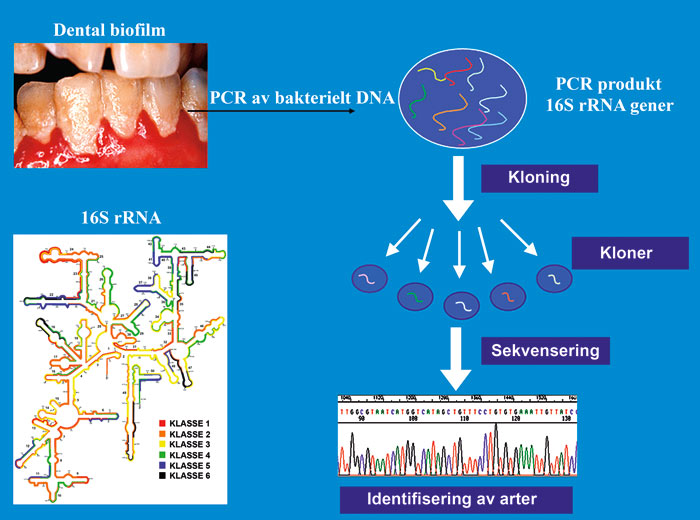
Figur 4. Identifisering av bakterier med molekylære teknikker. DNA av bakterier fra kliniske prøver blir isolert og renset, 16S rRNA-gener kopiert (PCR), klonet og sekvensert. Basesekvenser av 16S rRNA-gener blir sammenlignet mot internasjonale genbanker for identifisering av bakterier. 16S rRNA-genet inneholder ulike regioner som er tilgjengelige for kopiering (PCR). Basert på molekylstrukturen til 16S rRNA-genet er de ulike regionene av genet klassifisert etter grad av tilgjengelighet (grad 1 – lett, grad 6 – vanskelig).
Metagenomikk
Det er frem til i dag utført mange deskriptive studier i arbeidet med å identifisere medlemmene av den totale mikrofloraen. Mangfoldet av arter som er påvist med molekylære teknikker åpner for mange nye spørsmål. For en bedre forståelse av mikrofloraen vil videre forskning fokusere på genetisk diversitet, funksjon, økologiske roller og populasjonsstruktur.
Dette arbeidet har allerede startet i form av komplekse analyser av mikrobielle samfunn. Metagenomikk er en funksjons- og sekvenseringsanalyse av hva som er genetisk til stede og uttrykt i en klinisk prøve. Analysene gir innsyn i det genetiske potensialet til komplekse mikrobielle samfunn ved et gitt tidspunkt, inkludert den ikke dyrkbare delen av bakteriefloraen. Behovet for denne kunnskapen har initiert store sekvenseringsprosjekter av mikrobielle samfunn og store sett av metagenomiske sekvenser fra ulike kliniske tilstander. Med tilgangen til metagenomiske sekvenser og det stadig økende antallet komplette sekvenser av bakteriegenomer, er det mulig å inkludere postgenomiske teknikker som proteomikk i analysene av mikrobielle samfunn. Analysene av proteinene som er uttrykt, gjenspeiler de funksjonelle dimensjonene ved mikrobielle samfunn. I tillegg kan man oppnå et av hovedmålene med teknikkene, nemlig å knytte individuelle bakteriearter til funksjon. To metagenomiske bibliotek ble konstruert av DNA fra fecesprøver fra friske individer og individer med Crohns sykdom. Individer med Crohns sykdom hadde en påfallende lav diversitet blant bakteriene i en av de mest sentrale bakteriegruppene (Firmicutes) i tarmfloraen. Forfatterne av denne studien mener disse resultatene støtter hypotesen om at tarmfloraen spiller en viktig rolle ved utvikling av Crohns sykdom (35). Det knyttes store forventninger til tilsvarende studier på de komplekse infeksiøse orale sykdommene.
Definisjoner
Autogen – som er oppstått i kroppen eller fremstilt av materiale fra egen kropp.
Fenotype – egenskaper ved individet, formet av arv og miljø.
Isolat – isolerte bakteriearter fra en sammensatt bakteriekultur.
Habitat – området eller miljøet hvor en organisme eller et økologisk samfunn normalt lever.
Homeostase – evnen eller tendensen til en organisme eller et økologisk samfunn til å opprettholde likevekt ved å tilpasse seg fysiologiske prosesser.
Økologi – kunnskapen om samspillet mellom ulike former for liv og hvordan de avhenger av omgivelsene og hverandre.
Proteolyse – spalting av protein; hydrolyse av peptidbindingene i proteinmolekyler til dannelse av mindre polypeptid.
Mikrobiota – Mikroflora og mikrofauna som består av mikroorganismer.
DNA-DNA hybridisering – molekylær teknikk som måler grad av genetisk likhet mellom DNA sekvenser. Benyttes for å bestemme genetisk likhet eller distanse mellom arter.
Fylogeni – Avstamningshistorie. Evolusjonshistorien til en organisme. En evolusjonær sammenheng mellom grupper av organismer. Gir et familietre som viser genetisk sammenheng mellom forfedre og etterkommere.
Fylotype – en bakterieart som er genetisk unik fra andre bakteriearter.
Translasjonsapparatet – inngår i proteinsyntesen, genetiske koder fra rRNA (via tRNA) koder for sekvenser av aminosyrer som settes sammen til proteiner.
Genetisk populasjonsstruktur – genetisk variasjon innen et bakterielt samfunn.
Metagenomikk – studier av genetisk materiale fra en prøve hentet direkte fra et miljø.
Proteomikk – studier og analyser av proteomer – en celle eller et individs samlede antall uttrykte proteiner.
English summary
Periodontal microflora; from specificity to complexity
Periodontitis is known as a complex multifactorial disease including etiological factors of the host. The literature shows that the subgingival microbiota is accepted as a major etiological factor of periodontal diseases. Bacterial identification based on the presence of 16S rRNA-genes has revealed a diverse bacterial flora of the oral cavity. A previous focus on a few pathogenic bacteria is now replaced by the attention to complex microbial communities to understand infectious diseases. Metagenomics is a technology established to expand the understanding of how complex microbial communities function and how microbes interact with each other. The ecological plaque hypothesis and new molecular techniques will contribute with new knowledge to complex oral diseases.
Aas JA, Olsen I. Periodontal mikroflora – fra spesifisitet til kompleksitet. Nor Tannlegeforen Tid. 2008;118:648–54. doi:10.56373/2008-10-4
Hovedbudskap | |
|---|---|
• |
Den periodontale bakteriefloraen har gjennom historien vært en omstridt etiologisk faktor ved periodontitt |
• |
Molekylærgenetiske teknikker og den økologiske plakkhypotesen vil gi økt forståelse av komplekse orale sykdommer |
• |
Ny forståelse av infeksiøse sykdommer vil erverves gjennom forskning på egenskaper ved mikrobielle samfunn fremfor enkelte patogene mikrober |
Referanser
1. Porter JR. Antony van Leeuwenhoek: tercentenary of his discovery of bacteria. Bacteriol Rev 1976; 40: 260 – 9.
2. Fauchard P. Le chirurgien-dentiste. 2nd. ed. Paris: Mariette; 1746. p. 1 – 494.
3. Hunter J. The natural history of the human teeth, explaining their structure use, formation, growth and disease. London: Johnson; 1771. p. 1 – 128.
4. Miller WD. The microorganisms of the human mouth. Philadelphia: SS White Dental Mfg Co; 1890.
5. Irgens LM. Oppdagelsen av leprabasillen. Tidsskr Nor Lægeforen 2002; 122: 708 – 9.
6. Meyer KF. The present status of dental bacteriology. J Am Dent Assoc 1917; 4: 966 – 96.
7. Medalia LS. The present status of alveolar osteomyelitits pyorrhea alveolaris. Its causes and treatment and vaccines. Dent Cosmos 1916; 58: 1000 – 12.
8. McGehee WHO. Stock vaccines in the treatment of pyorrhea alveolaris. Dent Cosmos 1912; 54: 997 – 1002.
9. Socransky SS, Haffajee AD. Evidence of bacterial etiology: a historical perspective. Periodontology 2000 1994; 5: 7 – 25.
10. Hoffman GM. Pyorrhea and autogeneous vaccines. Dent Cosmos 1919; 61: 1095.
11. McCall JO, Box HK. The pathology and diagnosis of the basic lesions of chronic periodontitis. J Am Dent Assoc 1925; 12: 1300 – 9.
12. Beckwith TD, Simonton FV, Williams A. A histologic study of the gum in pyorrhea. J Am Dent Assoc 1925; 12: 129 – 53.
13. Daley FH. Vincent’s gingivitis in Boston in 1926. Apollonium 1927; 2: 69 – 83.
14. Gottlieb B. The formation of the periodontal pocket: diffuse atrophy of the alveolar bone. J Am Dent Assoc 1928; 15: 462 – 74.
15. Becks H. What factors determine the early stage of paradentosis (pyorrhea)? J Am Dent Assoc 1931; 18: 922 – 31.
16. Orban B, Weinmann JP. Diffuse atrophy of the alveolar bone (periodontosis). J Periodontol 1942; 13: 31 – 45.
17. Keyes PH, Jordan HV. Periodontal lesions in the Syrian hamster. III. Findings related to an infectious and transmissible component. Arch Oral Biol 1964; 9: 377 – 400.
18. MacDonald I, Sutton RM, Knoll ML, Madlener EM, Grainger RM. The pathogenic components of an experimental mixed infection. J Infect Dis 1956; 98: 15 – 20.
19. Löe H, Theilade E, Jensen SB. Experimental gingivitis in man. J Periodontol 1965; 36: 177 – 87.
20. Theilade E, Wright WH, Jensen SB, Löe H. Experimental gingivitis in man. II. A longitudinal clinical and bacteriological investigation. J Periodontal Res 1966; 1: 1 – 13.
21. Blake GC. The microbiology of acute ulcerative gingivitis with reference to the culture of oral trichomonads and spirochaetes. Proc R Soc Med 1968; 61: 131 – 6.
22. Tanner AC, Haffer C, Bratthall GT, Visconti RA, Socransky SS. A study of the bacteria associated with advancing periodontitis in man. J Clin Periodontol 1979; 6: 278 – 307.
23. Slots J, Reynolds HS, Genco RJ. Actinobacillus actinomycetemcomitans in human periodontal disease: a cross-sectional microbiological investigation. Infect Immun 1980; 29: 1013 – 20.
24. Newman MG. Anaerobic oral and dental infection. Rev Infect Dis 1984; 6: S107 – 14.
25. Loesche WJ. The specific plaque hypothesis and the antimicrobial treatment of periodontal disease. Dent Update 1992; 19: 68, 70 – 2, 74.
26. Socransky SS. Microbiology of plaque. Compend Contin Educ Dent 1984; 5: S53 – 6.
27. Moore WE, Moore LV. The bacteria of periodontal diseases. Periodontol 2000 1994; 5: 66 – 77.
28. Marsh PD. Sugar, fluoride, pH and microbial homeostasis in dental plaque. Proc Finn Dent Soc 1991; 87: 515 – 25.
29. Armitage GC. Development of a classification system for periodontal diseases and conditions. Ann Periodontol 1999; 4: 1 – 6.
30. Baelum V, Lopez R. Defining and classifying periodontitis: need for a paradigm shift? Eur J Oral Sci 2003; 111: 2 – 6.
31. Socransky SS, Haffajee AD, Cugini MA, Smith C, Kent Jr. RL. Microbial complexes in subgingival plaque. J Clin Periodontol 1998; 25: 134 – 44.
32. Socransky SS, Gibbons RJ, Dale AC, Bortnick L, Rosenthal E, MacDonald JB. The microbiota of the gingival crevice area of man. I. Total microscopic and viable counts and counts of specific organisms. Arch Oral Biol. 1963; 8: 275 – 280.
33. Paster BJ, Boches SK, Galvin JL, Ericson RE, Lau CN, Levanos VA, et al. Bacterial diversity in human subgingival plaque. J Bacteriol 2001; 183: 3770 – 83.
34. Aas JA, Paster BJ, Dewhirst FE, I Olsen. Hva har nye teknikker lært oss om den normale mikrofloraen i munnhulen? Nor Tannlegeforen Tid 2006; 116: 976 – 82.
35. Manichanh C, Rigottier-Gois L, Bonnaud E, Gloux K, Pelletier E, Frangeul L, et al. Reduced diversity of faecal microbiota in Crohn"s disease revealed by a metagenomic approach. Gut 2006; 55: 205 – 11.
Adresse: Postboks 1052 Blindern, 0316 Oslo. E-post: jornaaas@odont.uio.no
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Aas JA, Olsen I. Periodontal mikroflora – fra spesifisitet til kompleksitet. Nor Tannlegeforen Tid. 2008;118:648–54. doi:10.56373/2008-10-4