Antibiotikaresistens hos orale bakterier
Antibiotika og andre antimikrobielle medikamenter har revolusjonert behandlingen av infeksiøse sykdommer. Uheldig bruk av antibiotika gjennom flere år har ført til utvikling av resistens hos bakterier som er årsak til ulike infeksjoner. Resistens mot antibiotika er en stor trussel og gjør det vanskeligere å behandle en rekke infeksjonssykdommer. Antibiotikaresistens hos orale bakterier er også et økende problem ved behandling av dentale infeksjoner. I de senere år har det blitt rapportert om endringer i tannlegers forskrivning av antibiotika i retning fra smalspektrede til bredspektrede typer av antibiotika. Vi har nylig vurdert forekomsten av resistens og bruk av antibiotika av tannleger i Norge. Resistens hos orale bakterier ser i dag ut til å være et lite problem i Norge. Forskriving av smalspektret fenoksymetylpenicillin er dominerende blant norske tannleger.
Antibiotika og andre antimikrobielle medikamenter har revolusjonert behandlingen av infeksiøse sykdommer. Kort tid etter oppdagelsen av antibiotika mot grampositive og gramnegaitive bakterier mente mange leger at den lange kampen mot infeksjoner var vunnet. Imidlertid har den omfattende bruken av antibiotika ført til at bakterier har utviklet resistens. Dette har medført at det finnes stammer av bakterier der det mangler effektive antibiotika (1). Resistens mot antibiotika betraktes nå som en alvorlig trussel mot den generelle folkehelsen, og det er en prioritert oppgave å få denne negative utviklingen under kontroll (2, 3). Antibiotikaresistens hos orale bakterier er også et økende problem ved behandling av dentale infeksjoner (4).
Utvikling av resistente bakterier kan skje ved mutasjoner i eksisterende genom eller som oftest ved horisontal genoverføring. Ved horisontal genoverføring blir resistente determinanter overført ved hjelp av genetiske elementer (plasmider, transposoner eller integroner) som da kan innføres i en bakterie og gjøre den resistent. Overføring av plasmider, transposoner eller integroner skjer via konjugasjon, transformasjon eller transduksjon til andre bakterier. Animasjoner som beskriver disse mekanismene kan sees på nettsider fra amerikanske Food and Drug Administration (http:www.fda.gov/cvm/antiresistvideo.htm).
Bruk av antibiotika vil øke spredningen av den resistente stammen når den nye bakterien har etablert seg og flere studier viser sammenheng mellom utvikling av bakteriell resistens og bruk av antibiotika (5, 6). Antibiotika vil gi et selektivt trykk på bakteriepopulasjoner og medføre en forskyvning av likevekten mellom resistente og mottakelige bakterier i retning av den førstnevnte (7). Det er derfor viktig å ha god kontroll på bruken av disse legemidlene. Dette forutsetter at antibiotika brukes på riktige indikasjoner.
Mekanismer ved utvikling og forekomst av antibiotikaresistens hos orale bakterier
Den kliniske definisjonen på antibiotikaresistens er «evnen som bakterier har til å mangfoldiggjøre seg i nærvær av antimikrobielle midler når disse brukes i terapeutiske doser» (8). Orale bakterier er ikke noe unntak fra fenomenet bakteriell resistens. I senere år har man kunnet registrere at orale bakterier har fått redusert virkning overfor forskjellige typer av antibiotika. Da antibiotika i noen tilfeller er nødvendig for å ivareta pasientens generelle helse bør man være oppmerksom på dette problemet i tannlegepraksis. (4). I senere år er det blitt rapportert om endringer i tannlegers forskrivning av antibiotika, fra smalspektrede til bredspektrede typer (9, 10). Dette kan være årsaken til den registrerte økningen av bakterielle isolater overfor bredspektrede antibiotika. Et eksempel er amoksicillin med klavulat som var det oftest forskrevne antibiotikum i tannlegepraksis i Spania i 2005 (10). I en undersøkelse fra 2004 ble det påvist at opptil 42 % av Prevotella-species (n=303) utviklet resistens overfor amoksicillin (11).
Mekanismene som orale bakterier bruker for å utvikle resistens overfor antibiotika er en av følgende (Figur 1): (i) Målmolekylet blir endret strukturelt slik at antibiotika ikke kan bindes til det. Endringen kan skje ved modifikasjon av såkalte proteinbindende proteiner (PBP). Dette igjen kan forekomme ved mutasjon i kromosomale gener som koder for enzymer eller ved opptak av fremmede homologe gener eller genfragmenter fra relaterte species som koder for nye PBP som er resistente overfor b-laktamantibiotika. Mekanismen forekommer ofte hos orale streptokokker. (ii) Antibiotika hindres i å komme inn i cellen. Mange typer av antibiotika benytter porin-kanalene når de går inn i gram-negaitive bakterieceller.
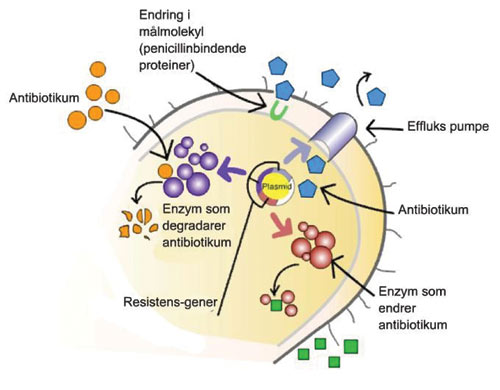
Figur 1. Mekanismer for utvikling av antibiotikaresistens i bakterier.
Dersom bakterier viser redusert ekspresjon av poriner vil dette resultere i impermeable bakterier eller i et redusert opptak av antibiotika som ofte leder til antibiotikaresistens. (iii) Antibiotika blir pumpet ut av cellen gjennom en mekanisme kjent som efflux-pumpen. Bakterier kan ved resistens aktivt pumpe ut de antimikrobielle agens og derved forhindre opplagring inne i bakterien. Et eksempel på en slik mekanisme påvist hos orale bakterier, er den resistensen som forekommer blant gram-negaitive bakterier overfor tetracyklin. Dette skyldes tilstedeværelse av tetB-effluxgenet. Dette genet er blitt påvist i stammer av Aggregatibacter (tidligere Actinobacillus) actinomycetemcomitans og Treponema denticola. (iv) Antibiotika blir inaktivert, for eksempel gjennom enzymatisk degradering. Det mest vanlige eksempel ved denne mekanismen er resistens mot b-laktamantibiotika på grunn av b-laktamaser. Nærvær av b-laktamaser blant orale bakterier er veldokumentert i litteraturen (12, 13). Prevotella species er rapportert å være den mest utbredte bakterien i cavum oris som produserer b-laktamaser (14 – 16). Vi har beskrevet kliniske isolater av Fusobacterium nucleatum som produserer klasse D b-laktamaser (17).
Forekomst av ampicillin- og metronidazol-resistente stammer hos pasienter i Norge
Forekomsten av resistens overfor 2 mg/ml ampicillin og 2 mg/ml metronidazol i subgingivale bakterier isolert fra 21 pasienter i behandling hos tannleger i Bergen, ble nylig undersøkt ved vårt laboratorium. Resultatene presenteres i Tabell 1 og viser lav forekomst av resistens overfor ampicillin og metronidazol.
Ampicillin resistens (2 g/ml) |
Metronidazol resistens (2 g/ml) |
|
|---|---|---|
Bakterieart |
Antall positive prøver/totalantall pasienter undersøkt |
Antall positive prøver/totalantall pasienter undersøkt |
Porphyromonas gingivalis |
0/21 |
1/21 |
Prevotella intermedia |
0/21 |
0/21 |
Aggregatibacter actinomycetemcomitans |
7/21 |
5/21 |
Eikenella corrodens |
5/21 |
4/21 |
Campylobacter rectus |
1/21 |
1/21 |
Capnocytophaga gingivalis |
0/21 |
1/21 |
Fusobacterium nucleatum |
0/21 |
2/21 |
Peptostreptococcus micros |
0/21 |
0/21 |
Eubacterium nodatum |
2/21 |
2/21 |
Streptococcus oralis |
0/21 |
0/21 |
Streptococcus sanguis |
0/21 |
0/21 |
Streptococcus constellatus |
3/21 |
5/21 |
Streptococcus gordonii |
0/21 |
0/21 |
Streptococcus mitis |
0/21 |
0/21 |
Streptococcus intermedius |
0/21 |
2/21 |
Tannerella forsythensis |
1/21 |
1/21 |
Veillonella parvula |
0/21 |
2/21 |
Streptococcus mutans |
0/21 |
0/21 |
Antibiotikabruk og resistens
Resistensutvikling representerer et særtrekk i bakterieevolusjonen som er genetisk bestemt og gir en fordel i evnen til å overleve. Seleksjonstrykket på bakteriepopulasjonen, ved bruk av antibiotika er en drivkraft for videre utvikling av resistente bakterier (7). På denne måten vil bakteriekloner kontinuerlig selekteres som en evolusjonær respons på bruk av antibiotika. Omfanget av denne seleksjonen bestemmes av det totale konsum av antibiotika.
I det mikrobielle økosystemet vil forholdet mellom antibiotikafølsomme og antibiotikaresistente bakterier nå likevekt (18). Denne likevekten bestemmes av tilpasningen av følsomme og resistente bakteriestammer, og inkluderer evne til overføring, genetisk basis og stabilitet med hensyn på resistens, med omfanget av seleksjonstrykket. Når likevekt er nådd, vil det være vanskelig å redusere resistensnivået (19). Ved å begrense bruken av antibiotika, kan man forhindre at resistens opptrer og sprer seg (20, 21). Til tross for forbedret diagnostikk av infeksjoner forårsaket av bakterier samt at mange land følger retningslinjer for antibiotikabehandling og har pålagte restriksjoner for bruk utenom humanmedisin, øker den globale resistensen. Globalt er det et stort overforbruk av antibiotika, og ofte brukes antibiotika basert på feilaktige medisinske indikasjoner. Pasienten kan få feil antibiotikum eller det kan være feil dosering, eller det kan administreres på feil måte. Varigheten av kuren kan også være ukorrekt (22, 23).
Omfanget av forskrevet antibiotika kan beregnes ved bruk av nasjonale databaser. Ved Nasjonalt Folkehelseinstitutt er det etablert et reseptbasert legemiddelregister, kalt Reseptregisteret, som inneholder opplysninger fra alle apotek om utlevering av legemidler til pasienter, leger og institusjoner. Det statistiske materialet er organisert i databasen i samsvar med Anatomical Therapeutic Chemical (ATC) klassifisering, der en teknisk enhet kalt Defined Daily Dose (DDD) brukes som enhet på antibiotikaforbruk, uavhengig av type antibiotika. DDD vil utgjøre den gjennomsnittlige vedlikeholdsdosen per dag for et antibiotikum for en voksen pasient, og viser ikke den anbefalte eller forskrevne daglige dose. En hensikt med ATC/DDD er å ha et redskap for å bedre kvaliteten ved bruken av antibiotika. Fra databasen kan man også sammenligne konsum nasjonalt og internasjonalt. Omfanget av antibiotika til polikliniske pasienter uttrykkes som antall DDD per 1000 innbyggere per dag (DID).
Forskrevet av tannlege |
Forskrevet av tannlege |
||||
|---|---|---|---|---|---|
Antibiotikum |
2004 |
2005 |
Antibiotikum |
2004 |
2005 |
Fenoksymetylpenicillin |
75 % |
73 % |
Azitromycin |
1,2 % |
1,1 % |
Metronidazol |
6,3 % |
6,9 % |
Spiramycin |
0,7 % |
0,6 % |
Erytromycin |
4,9 % |
5 % |
Tetracyklin |
0,7 % |
0,5 % |
Amoksicillin |
4,6 % |
4,7 % |
Oksytetracyklin |
0,2 % |
0,2 % |
Klindamycin |
3,7 % |
4,4 % |
Klaritromycin |
0,08 % |
0,00 % |
Doksysyclin |
2,3 % |
2,2 % |
|||
Antibiotika forskrevet av tannleger i Norge
Tannleger har rett til å forskrive antibiotika. Det blir forskrevet langt mindre antibiotika av tannleger enn av leger. I USA er det beregnet at tannleger står for 9 % av totalt forskrevet antibiotika (24). I Canada forskriver tannlegene i gjennomsnitt 4 resepter per uke, i England 3 resepter per uke (4, 25). Det relative bidrag fra tannhelsesektoren kan likevel være meget høy for visse typer antibiotika (26). Derfor er det viktig at tannleger også legger vekt på klok og forsiktig bruk av antibiotika.
Vi har nylig vurdert forekomsten av forskrivning av antibiotika foretatt av tannleger i Norge. Totalt ble 268 834 forskrifter av tannleger i 2004 og 2006 evaluert (26). Resultatet av disse undersøkelsene viser at smalspektret fenoksymetylpenicillin er dominerende blant norske tannleger. Dette kan tyde på at norske tannleger er konservative og forsiktige når de forskriver antibiotika. Disse funnene støtter, i alle fall til en viss grad, tidligere funn som viste at ampicillin- og metronidazolresistens blant subgingivale bakterier er beskjedent i Norge (27). I tillegg viste vi for første gang data med oversikt over norske tannlegers bruk av 11 antibiotika, hvor Verdens Helseorganisasjon (WHO) sine enheter DDD er benyttet (Tabell 3).
Forekrevet antibiotikum |
Antall forskrifter fra tannleger |
Tannlegers bidrag (%) til nasjonal DDDsa forbruk |
Antall DIDsbBidrag fra tannleger |
||||||
|---|---|---|---|---|---|---|---|---|---|
2004 |
2005 |
2004 |
2005 |
2004 |
2005 |
||||
Fenoksymetyl-penicillin |
98387 |
101624 |
15,7 % |
15,2 % |
5 789 |
6 018 |
|||
Metronidazol |
8276 |
9502 |
13,2 % |
16,2 % |
227 |
272 |
|||
Erytromycin |
6491 |
6939 |
3,0 % |
2,9 % |
294 |
314 |
|||
Amoksicillin |
6090 |
6523 |
4,7 % |
4,7 % |
386 |
427 |
|||
Klindamycin |
4862 |
6130 |
8,3 % |
8,6 % |
125 |
160 |
|||
Doksycyklin |
3034 |
3160 |
1,4 % |
1,4 % |
232 |
240 |
|||
Azitromycin |
1581 |
1593 |
1,8 % |
1,6 % |
50 |
50 |
|||
Spiramycin |
990 |
956 |
15,0 % |
15,5 % |
21 |
20 |
|||
Tetracyklin |
944 |
786 |
1,1 % |
0,9 % |
69 |
60 |
|||
Oksytetracyklin |
355 |
365 |
0,9 % |
1,0 % |
18 |
20 |
|||
Klaritromycin |
118 |
128 |
0,2 % |
0,2 % |
9 |
7 |
|||
Klinisk betydning av antibiotikaresistens hos orale bakterier
I mange kliniske situasjoner vil empirisk valg av antibiotika vanligvis være avgjørende ved behandling av infeksjoner forårsaket av bakterier. Antibiotikabehandling basert på empiri er vanlig i tannlegepraksis, mens prøvetaking og testing av bakteriers følsomhet for antibiotika er begrenset. Det er derfor viktig at behandling basert på empiri har stor sannsynlighet for å lykkes. Noen ganger må et mye brukt førstevalgs-antibiotikum erstattes av mer potente antibiotika for å overvinne resistens og gi pasienten tryggere behandling. Denne spesielle situasjonen kan føre klinikeren, f.eks. tannlegen, inn i en ond sirkel, der økende resistens medfører bruk av bredspektrede og mer potente antimikrobielle midler, som igjen kan forsterke problemet med antibiotikaresistens.
I noen land har det blant tannleger blitt dokumentert en endring fra å forskrive smalspektret til bredspektret antibiotika, og dette knyttes til en økning i resistensen hos orale bakterier (4). I Norge er ikke dette noe stort problem, da smalpektrede antibiotika, som nevnt, blir foretrukket (26).
Kolonisering av antibiotikaresistente orale bakterier kan også ha betydning for pasientens allmenntilstand. Hospitalisierte pasienter har vært utsatt for sykehusinfeksjoner med orale streptokokker (28). I tillegg er munnhulen et unikt habitat for mikroorganismer, og mer enn 700 bakteriearter er blitt identifisert fra munnhulen. Tilstedeværelsen av resistente bakterier i munnhulen kan gjøre denne til et reservoar for spredning og overføring av resistens både til andre bakterier som befinner seg i munnhulen, og til bakterier som passerer, kanskje også til bakterier i nedre del av mage-tarmkanal. Mye tyder på at det foregår horisontal overføring av gener som koder for antibiotikaresistens blant orale bakterier og at dette kan skje både mellom samme arter og ulike arter (29).
Antibiotikaresistens hos orale bakterier kan representere et problem i tannlegepraksis. Forsiktig og riktig bruk av antibiotika må alltid betraktes som et middel til å hindre resistens. Resistens hos orale bakterier ser i dag ut til å være et lite problem i Norge takket være fornuftig forskrivningspraksis.
English summary
Antibiotic resistance among oral bacteria
The use of different antibiotics over many years has led to the emergence of infectious bacteria that are resistant not only to one but to several antibiotics. Antibiotic resistance in oral microbes is an issue of concern in general dental practice where antibiotics are, in some cases, essential. In recent years, a shift from narrow-spectrum to broad-spectrum antibiotic prescriptions has been reported, and the increase of bacterial isolates resistant to the narrow spectrum antibiotics is blamed for such a shift in prescription practices. The antibiotic resistance among oral bacteria in Norway and the use of antibiotics by dentists in Norway were recently evaluated by our group. Our findings revealed that oral bacterial resistance in Norway seems to be a limited problem. At present, advantageous prescription practices by dentists in Norway prevaile.
Al-Haroni M, Lygre H, Bakken V. Antibiotikaresistens hos orale bakterier. Nor Tannlegeforen Tid. 2008;118:704–8. doi:10.56373/2008-11-3
Referanser
1. Falagas ME, Bliziotis IA. Pandrug-resistant gram-negative bacteria: the dawn of the post-antibiotic era? Int J Antimicrob Agents 2007; 29: 630 – 6.
2. Wise R, Hart T, Cars O, Streulens M, Helmuth R, Huovinen P, et al. Antimicrobial resistance. Is a major threat to public health. Bmj 1998; 317: 609 – 10.
3. WHO report on infectious diseases. Wkly Epidemiol Rec 1999; 74: 279.
4. Sweeney LC, Dave J, Chambers PA, Heritage J. Antibiotic resistance in general dental practice – cause for concern? J Antimicrob Chemother 2004; 53: 567 – 76.
5. Feres M, Haffajee AD, Allard K, Som S, Goodson JM, Socransky SS. Antibiotic resistance of subgingival species during and after antibiotic therapy. J Clin Periodontol 2002; 29: 724 – 35.
6. Goossens H, Ferech M, Vander Stichele R, Elseviers M. Outpatient antibiotic use in Europe and association with resistance: a cross-national database study. Lancet 2005; 365: 579 – 87.
7. Levy SB, Marshall B. Antibacterial resistance worldwide: causes, challenges and responses. Nat Med 2004; 10: S122 – 9.
8. Andersson D. The ways in which bacteria resist antibiotics (background document). Seminar on the Global Threat of Antibiotic Resistance – Exploring Roads Towards Concerted Action; 2004.
9. Palmer NO, Martin MV, Pealing R, Ireland RS. An analysis of antibiotic prescriptions from general dental practitioners in England. J Antimicrob Chemother 2000; 46: 1033 – 5.
10. Poveda Roda R, Bagan JV, Sanchis Bielsa JM, Carbonell Pastor E. Antibiotic use in dental practice. A review. Med Oral Patol Oral Cir Bucal 2007; 12: E186 – 92.
11. Koeth LM, Good CE, Appelbaum PC, Goldstein EJ, Rodloff AC, Claros M, et al. Surveillance of susceptibility patterns in 1297 European and US anaerobic and capnophilic isolates to co-amoxiclav and five other antimicrobial agents. J Antimicrob Chemother 2004; 53: 1039 – 44.
12. Handal T, Olsen I, Walker CB, Caugant DA. Beta-lactamase production and antimicrobial susceptibility of subgingival bacteria from refractory periodontitis. Oral Microbiol Immunol 2004; 19: 303 – 8.
13. Handal T, Olsen I, Walker CB, Caugant DA. Detection and characterization of beta-lactamase genes in subgingival bacteria from patients with refractory periodontitis. FEMS Microbiol Lett 2005; 242: 319 – 24.
14. Legg JA, Wilson M. The prevalence of beta-lactamase producing bacteria in subgingival plaque and their sensitivity to Augmentin. Br J Oral Maxillofac Surg 1990; 28: 180 – 4.
15. Fosse T, Madinier I, Hitzig C, Charbit Y. Prevalence of beta-lactamase-producing strains among 149 anaerobic gram-negative rods isolated from periodontal pockets. Oral Microbiol Immunol 1999; 14: 352 – 7.
16. Nyfors S, Kononen E, Takala A, Jousimies-Somer H. Beta-lactamase production by oral anaerobic gram-negative species in infants in relation to previous antimicrobial therapy. Antimicrob Agents Chemother 1999; 43: 1591 – 4.
17. Al-Haroni M, Skaug N, Bakken V, Cash P. Proteomic analysis of ampicillin-resistant oral Fusobacterium nucleatum. Oral Microbiol Immunol 2008; 23: 36 – 42.
18. Austin DJ, Anderson RM. Studies of antibiotic resistance within the patient, hospitals and the community using simple mathematical models. Philos Trans R Soc Lond B Biol Sci 1999; 354: 721 – 38.
19. Seppala H, Klaukka T, Vuopio-Varkila J, Muotiala A, Helenius H, Lager K, et al. The effect of changes in the consumption of macrolide antibiotics on erythromycin resistance in group A streptococci in Finland. Finnish Study Group for Antimicrobial Resistance. N Engl J Med 1997; 337: 441 – 6.
20. Nourse C, Byrne C, Murphy H, Kaufmann ME, Clarke A, Butler K. Eradication of vancomycin resistant Enterococcus faecium from a paediatric oncology unit and prevalence of colonization in hospitalized and community-based children. Epidemiol Infect 2000; 124: 53 – 9.
21. Montecalvo MA, Jarvis WR, Uman J, Shay DK, Petrullo C, Rodney K, et al. Infection-control measures reduce transmission of vancomycin-resistant enterococci in an endemic setting. Ann Intern Med 1999; 131: 269 – 72.
22. Canet JJ, Garau J. Importance of dose and duration of beta-lactam therapy in nasopharyngeal colonization with resistant pneumococci. J Antimicrob Chemother 2002; 50 Suppl S2: 39 – 43.
23. Larrabee T. Prescribing practices that promote antibiotic resistance: strategies for change. J Pediatr Nurs 2002; 17: 126 – 32.
24. Pallasch TJ. Antibiotic resistance. Dent Clin North Am 2003; 47: 623 – 39.
25. Epstein JB, Chong S, Le ND. A survey of antibiotic use in dentistry. J Am Dent Assoc 2000; 131: 1600 – 9.
26. Al-Haroni M, Skaug N. Incidence of antibiotic prescribing in dental practice in Norway and its contribution to national consumption. J Antimicrob Chemother 2007; 59: 1161 – 6.
27. Al-Haroni MH, Skaug N, Al-Hebshi NN. Prevalence of subgingival bacteria resistant to aminopenicillins and metronidazole in dental patients from Yemen and Norway. Int J Antimicrob Agents 2006; 27: 217 – 23.
28. Dettenkofer M, Wenzler-Rottele S, Babikir R, Bertz H, Ebner W, Meyer E, et al. Surveillance of nosocomial sepsis and pneumonia in patients with a bone marrow or peripheral blood stem cell transplant: a multicenter project. Clin Infect Dis 2005; 40: 926 – 31.
29. Warburton PJ, Palmer RM, Munson MA, Wade WG. Demonstration of in vivo transfer of doxycycline resistance mediated by a novel transposon. J Antimicrob Chemother 2007; 60: 973 – 80.
Adresse: Mohammed Al-Haroni, Gades Institutt – Oral mikrobiologi, Universitetet i Bergen, Armauer Hansens Hus, 5021 Bergen. E-post: Mohammed.Al-Haroni@odont.uib.no
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Al-Haroni M, Lygre H, Bakken V. Antibiotikaresistens hos orale bakterier. Nor Tannlegeforen Tid. 2008;118:704–8. doi:10.56373/2008-11-3