Laserbehandling av infeksjoner ved tenner og dentale implantater
Laserbehandling har i mange år vært til stor nytte innen visse områder av klinisk medisin. I 2008 ble det utført en spørreundersøkelse i USA blant allmenntannleger og spesialister i periodonti om bruken av dentale lasere ved behandling av periodontale sykdommer (The Wealthy Dentist Newsletter). Femtitre prosent av tannlegene og 36 % av periodontistene rapporterte at de brukte laser i pasientbehandlingen. Disse tallene må selvsagt tolkes med forsiktighet, men indikerer likevel at laserbehandling i økende grad også er på vei inn i den odontologiske hverdagen. Med bakgrunn i den til dels tunge markedsføringen av laserbehandling ved periodontale sykdommer og peri-implantitt, er hensikten med denne artikkelen å beskrive laserens virkemåte, referere brukerveiledning og sikkerhetsrutiner og kritisk undersøke nytteverdien av laser ved behandling av infeksjoner rundt tenner og implantater.
Hovedkonklusjonen fra en gjennomgang av litteraturen er at laserbehandling ikke ser ut til å ha noen tilleggseffekt utover den effekten som en oppnår med tradisjonell lokal behandling. Det er mange ulike typer lasere på markedet, men for øyeblikket synes erbium: yttrium-aluminium-granat (Er:YAG)-laseren å være best egnet til bruk innen flere områder av odontologien. Denne laseren er trygg i bruk og ser ikke ut til å forårsake utilsiktede vevsskader.
Laserfysikk
Laser er et akronym for det engelske uttrykket «light amplification by the stimulated emission of radiation». Laserlys er optisk stråling i form av ultrafiolett stråling (ca.100 – 400 nm), synlig lys (ca. 400 – 700 nm) eller infrarød stråling (ca. 700 nm-10 µm). Under normale forhold vil et atom eller molekyl avgi lys (fotoner) i forbindelse med overgang fra et høyere og mer ustabilt (eksitert) energinivå til et lavere og mer stabilt nivå. Den forutgående spontane absorpsjonen av lys og likeledes den spontane avgivelsen, skjer uorganisert og tilfeldig, og lyset som dannes går i alle retninger (inkoherent; usammenhengende). Denne prosessen kalles spontan emisjon. I en laser blir atomer og molekyler som allerede er eksitert, stimulert til å avgi lys. Det skjer ved at det innkommende fotonet har energi som er nøyaktig tilpasset energiforskjellen mellom atomets eksiterte tilstand og grunntilstanden. Det elektromagnetiske feltet til det innkommende fotonet, med sin bestemte frekvens, stimulerer det eksiterte atomet til å sende ut et nytt foton. Dette fotonet får samme bølgelengde og beveger seg i samme retning og fase (lysbølgene beveger seg sammen i rom og tid) som det innkommende fotonet (koherent lys).
Lysforsterkning skjer både ved en dobling av antall fotoner i den stimulerte prosessen og ved at disse stimulerer emisjon i andre eksiterte atomer og molekyler. En forutsetning for at laserlys kan oppstå, er at det finnes flere atomer på et eksitert nivå enn i grunntilstanden eller på et lavere eksitert nivå (populasjonsinversjon). Dette oppnås ved tilførsel av energi fra en ekstern kilde («optisk pumping»). Denne kilden er som regel elektrisk strøm, men kan også være stråling fra en annen laser eller andre energikilder (Figur 1). Et tredje bidrag til lysforsterkning ligger i selve den fysiske utformingen av laserhulrommet eller laserkaviteten. Det eksiterende mediet gjøres langt og smalt, som for eksempel et gassfylt rør eller en stav av et fast stoff. Endene av lasermediet er belagt med et reflekterende materiale, vanligvis speil, slik at fotonene skal kunne reflekteres tilbake til lasermediet flere ganger og dermed stimulere til videre emisjon.
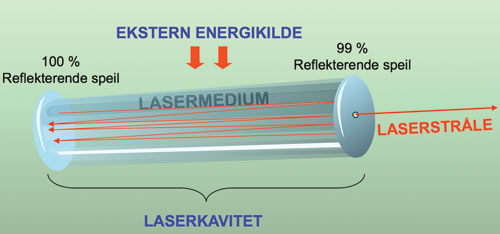
Figur 1. Prinsipiell virkemåte for laser; den eksterne energikilden eksiterer atomene i mediet i laserkaviteten. Etter kraftig lysforsterkning slippes en kollimert, koherent og monokromatisk laserstråle fra den minst reflekterende speilenden.
Overflaten i den ene enden av laserkaviteten er bare delvis reflekterende, slik at en del av lysbølgen, som etter hvert får svært høy intensitet, slipper ut og forlater kaviteten i form av laserstråling. Det er den gjentatte refleksjonen av lyset frem og tilbake inne i laserkaviteten som gjør at lyset blir så ensrettet (kollimert). Dette gir lys med høy energitetthet som kan nå svært langt. Laserstrålen er foruten å være koherent også monokromatisk (tilnærmet for noen lasere), hvilket vil si at alle bølgene har samme frekvens og bølgelengde (farge). (Mer detaljert informasjon om laserteori finnes i referanse 1).
Lasertyper
Det finnes mange ulike typer lasere med ulike bølgelengder og effektnivåer og som dermed har svært forskjellige bruksområder. Felles for alle er at de inneholder et lasermedium, som kan bestå av en gass, væske eller et fast stoff. Det er lasermediet som bestemmer utstrålingens bølgelengde og som gir opphav til laserens navn. For eksempel kommer navnet Er:YAG (erbium: yttrium-aluminium-granat)(eng.: garnet) av at lasermediet består av en faststoff-stav av krystallen yttrium aluminiumgranat med urenheter av erbium. Lasere som brukes innen odontologi er enten faststofflasere, inkludert diodelasere (halvlederlasere) eller gasslasere (Tabell 1). De sender ut stråling på grensen mellom synlig lys og nærinfrarød stråling eller i de nær- og midt-infrarøde bølgelengdeområdene.
Lasertype |
Bølgelengde (nm) |
Effekt (W) og/eller energi (J) |
Pulsvarighet (eller kontinuerlig bølge) |
Produsentens foreslåtte bruk |
Penetrasjonsdybde (mm) |
|---|---|---|---|---|---|
Diode (mange utgaver) |
810 – 980 |
10 mW-50 W |
0,0025 – 500 ms (og kontinuerlig) |
Ulike bløtvevsbehandlinger inkl. kirurgi og rensing, desensitisering, smertebehandling samt tannbleking |
<10 |
Nd:YAG (neodym: yttrium-aluminium-granat) |
1064 |
0,25 – 15 W og opptil 250 mJ |
0,05 – 0,3 ms |
Ulike bløt- og hardvevsbehandlinger, inkl. kirurgi, behandling av infeksjoner rundt tenner og implantater, samt tannbleking |
2 – 5 |
Er:YAG (erbium: yttrium-aluminium-granat) |
2940 |
Opptil 20 W og 600 mJ |
0,1 – 400 ms |
Ulike bløt- og hardvevsbehandlinger inkl. kirurgi samt behandling av infeksjoner rundt tenner og implantater |
1 |
Er,Cr: YSGG (erbium, krom: yttrium-selen-gallium-granat) |
2780 |
Opptil 8 W og 300 mJ |
0,14 – 0,7 ms |
Ulike bløt- og hardvevsbehandlinger inkl. kirurgi samt behandling av infeksjoner rundt tenner og implantater |
større enn Er:YAG, men atskillig mindre enn Nd:YAG |
CO2(karbondioksid) |
10 600 |
Opptil 60 W |
0,15 – 400 ms (og kontinuerlig) |
Ulike bløtvevsbehandlinger inkl. kirurgi samt behandling av infeksjoner rundt tenner og implantater |
0,03 – 0,1 |
En av de mest egnede laserne til bruk ved odontologisk behandling er Er:YAG-laseren. Den har en pulset utstråling, en bølgelengde på 2940 nm og en penetrasjonsdybde på en tusendels millimeter (1). Tidligere var bruken av denne laseren begrenset til preparering i hardvev, men den er nå videreutviklet til også å kunne brukes ved behandling av infeksjoner ved tenner og implantater. Er:YAG-laseren har egenskaper som gjør at den kan fjerne tannstein, men rensingen kan resultere i en heller ru overflate. God vannkjøling er nødvendig for å minske risikoen for å skade omkringliggende vev (2). En kan videre regulere følsomheten på «avtrekkeren» ved et «feed-back» system slik at laseren kun fyrer i kontakt med biofilm og tannstein. Det er vist at Er:YAG-laseren har både baktericid og detoksifiserende effekt (3, 4).
Øyeskader og sikkerhet
Huden og øyet er utsatte organer ved laserbruk på grunn av tilgjengelighet og evne til absorpsjon av optisk stråling. Øyet er spesielt utsatt fordi dette organet er gjennomtrengelig for synlig og nær-infrarød stråling, og øyelinsen kan fokusere laserstrålen på netthinnen. Til forskjell fra andre optiske kilder, er laserstrålen spesielt ensrettet (kollimert), smalbåndet og kan ha et høyt energiinnhold. Forbrenning av netthinnen og hornhinnen, katarakt samt termisk skade i kammeret foran linsen (som fører til redusert lysgang), er skader som kan oppstå etter eksponering fra lasere som benyttes i odontologisk behandling (Tabell 1). Skadepotensialet er avhengig av laserens egenskaper, slik som bølgelengde, irradians (effekt per flate), eksponeringsvarighet og størrelsen på bildet som blir dannet på netthinnen (5). Operatørfeil har vist seg å være den mest vanlige årsaken til medisinske skader forårsaket av laser (6). Noen sentrale punkter om lasersikkerhet er samlet i faktarammen.
Faktaramme
Lasersikkerhet
Ansvar: Viktigst er ansvarliggjøring av egen virksomhet og av leverandør. Leverandøren har ansvar for å gi tilstrekkelig brukerveiledning, inkludert instruksjoner i alle aspekter av sikker bruk. Brukere må etterspørre opplæring. Virksomheten har ansvaret for å gjennomføre sikkerhetstiltak og er ansvarlig for behandlingen. I tillegg skal virksomheten utpeke en strålevernsansvarlig person. Lasersikkerhet er en aktiv og kontinuerlig prosess.
Laserklasser: Inndeling i syv klasser (1, 1M, 2, 2M, 3R, 3B og 4) etter skadepotensiale, der 1 er lavest og 4 er høyest. Alle lasertyper brukt innen odontologi er klasse 4, bortsett fra enkelte diodelasere (oftest klasse 3B). Innkjøp, leasing eller lån av laser klasse 4 skal meldes til Statens strålevern (http://kilderegistrering.stralevernet.no/)
Merking ved klasse 3B og 4: Områder som er innenfor laserens strålingsrekkevidde skal være merket og avskjermet, og det skal foreligge tilfredsstillende merking og eventuelt lys-/lydsignal når laseren er i drift.
Personlige vernetiltak ved klasse 3B og 4: Alle personer som befinner seg i behandlingsrommet må bruke vernebriller som er spesielt tilpasset lasertypen i bruk (vær spesielt oppmerksom på merking av briller og at lasere kan ha mer enn én bølgelengde). Klær og gardiner bør bestå av ikke-brennbare stoffer (der det brukes klasse 4).
Kilder
European Committee for Standardization (CEN): Safety of laser products – Part 1: Equipment classification and requirements (EN 60825 – 1, 2007). Veileder for bruk av optisk stråling til medisinsk og kosmetisk behandling. Veileder nr. 8. Statens strålevern, 2006 (www.nrpa.no).
Virkning på vev
Når laserlys treffer vev, blir strålingen dels reflektert, dels absorbert av vevet og dels spredt i ulik grad og i forskjellige retninger. Spredningen er avhengig av vevsstruktur, bølgelengde og vevets evne til å absorbere den aktuelle bølgelengden. Hvor langt inn i vevet laserstrålen kan avgi energi (penetrasjonsdybden), avhenger blant annet av i hvor stor grad det finnes substanser som absorberer den bestemte bølgelengden. Laserstrålen kan trenge dypere inn der det skjer mindre absorpsjon. Substanser som absorberer optisk stråling kalles kromoforer. De viktigste kromoforer i orale vev er hemoglobin (oksy- og deoksyhemoglobin), melanin, hydroksylapatitt og vann.
Det forekommer generelt minimal eller ingen blødning ved bruk av laser. Koagulering kan oppnås på forskjellige måter, blant annet ved direkte absorpsjon av hemoglobin eller gjennom termiske effekter. Når vevet bestråles, enten i form av kontinuerlig bestråling eller i tidsbestemte pulser, øker temperaturen i mer eller mindre grad. Dersom laserstrålen penetrerer dypt, vil energien avsettes over et relativt stort område, og temperaturøkningen vil bli forholdsvis liten. Motsatt kan det utvikles mye varme når energien avsettes over et lite område eller over lengre tid. Temperaturøkningen er direkte relatert til varmeledningsevnen i det aktuelle vevet. Det benyttes ulike metoder for å holde temperaturen innenfor de grenser som minimaliserer skaden på omkringliggende vev. Disse metodene kan være vannkjøling, luftkjøling, avkjøling av vevet på forhånd og bruk av pulset fremfor kontinuerlig bestråling (1).
Vannabsorpsjonen kontra øvrige kromoforer i vev er den dominerende ved bølgelengder over ca. 1000 nm. I store trekk øker absorpsjonen med økende bølgelengde i det infrarøde området. Penetrasjonsdybden reduseres tilsvarende, slik at mer langbølget laserstråling som fra CO2- (bølgelengde 10 600 nm), Er:YAG- (2940 nm) og Er, Cr: YSGG-lasere (2740 nm) trenger mindre inn i vevet enn mer kortbølget stråling som den fra Nd:YAG (1064 nm) og diodelasere (ca. 800 – 1000 nm) (Tabell 1). I det nær-infrarøde området mellom ca. 700 og 1000 nm er både vannabsorpsjon og absorpsjon av de øvrige aktuelle kromoforer relativt lav (1).
Frem til 1994 dominerte Nd:YAG- og CO2-lasere innen odontologi, men det viste seg at laserstrålingen fra disse ikke fjernet tannstein uten å ødelegge det omkringliggende vevet. Utviklingen av Er:YAG- og Er,Cr: YSGG-lasere, som emitterer i nærheten av vannabsorpsjonsmaksimum, har bedret mulighetene for å fjerne tannstein og samtidig skåne omgivende bløtvev og tannsubstans (7). Ved anvendelse av vannkjøling, vil energien absorberes av det eksterne vannet, og temperaturen vil kunne kontrolleres. Med erbiumlasere kan en oppnå fotomekanisk ablasjon (fordampning) ved et lavere energinivå i tannstein enn i hardvev på grunn av det høyere vanninnholdet i tannstein (7). For å få tilgjengelighet til tannstein på rotoverflaten i riktig vinkel, er det for enkelte erbiumlasere blitt laget spesielle håndstykker og spisser (Figur 2).
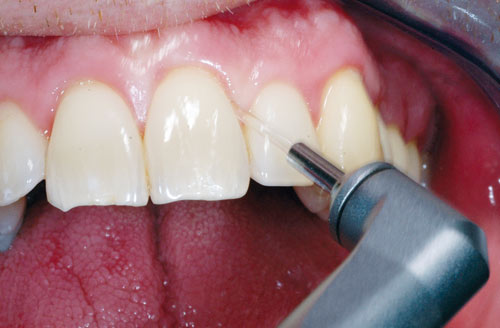
Figur 2. Behandling med Er:YAG-laser med spissen vinklet skrått mot rotoverflaten.
Litteraturgjennomgang
For å finne aktuelle artikler om temaet ble det utført elektronisk litteratursøk på PubMed databasen samt manuelt søk i flere tidsskrifter. Bare studier med minimum 12 ukers observasjonstid, minst 15 deltakere og publisert etter 2001 ble vurdert.
Infeksjoner ved tenner
En studie sammenlignet effekten av Nd:YAG-laser, CO2-laser og ultralydsrensing på 18 pasienter, der hver pasient hadde minimum to flater med sonderingsdybder på 5 mm eller mer (8). Tolv uker postoperativt ble det observert reduserte sonderingsdybder i alle tre gruppene. Forbedret klinisk feste og redusert blødning ved sondering ble kun observert for Nd:YAG og ultralydsrensing (8). Siden har flere studier rapportert om uheldige skadevirkninger som smelting, krakelering og karbonisering av rotoverflaten ved bruk av Nd:YAG- og CO2-laser (9).
Majoriteten av kontrollerte kliniske studier har sammenlignet Er:YAG-laser som monoterapi med konvensjonell instrumentering enten ved initialbehandling eller på vedlikeholdspasienter med kronisk periodontitt. I en studie utført etter «split-mouth design» ble 20 pasienter med moderat til avansert periodontitt inkludert (10). Hvert kontralaterale par med tenner ble randomisert og behandlet med enten laser alene eller laser i kombinasjon med subgingival scaling og rotplanering (SRP). Pasientene ble kontrollert 3, 6 og 12 måneder etter behandling. Begge gruppene viste en signifikant forbedring av alle undersøkte kliniske parametere. Den kombinerte behandlingen Er:YAG-laser og SRP så ikke ut til å gi noen tilleggseffekt ut over rensing med Er:YAG-laser alene (10).
Disse observasjonene ble seinere støttet av mikrobiologiske funn. Tilstedeværelsen og fordelingen av periopatogene bakterier hos 72 pasienter med kronisk periodontitt ble undersøkt etter behandling med håndinstrumenter, luft- og ultralydsscaler og Er:YAG-laser (11). Etter 3 måneder var det signifikant reduksjon av periopatogene bakterier i alle grupper, men laser og luftscaler ga ikke reduksjon av Aggregatibacter actinomycetemcomitans. Etter 6 måneder viste alle behandlinger en økning i antall bakterier (11).
I en annen studie ble 20 pasienter med moderat til avansert kronisk periodontitt behandlet med Er:YAG-laser og SRP etter «split-mouth design» (12). Resultatene ved 3 og 6 måneder viste en signifikant større reduksjon av blødning ved sondering og økt festegevinst etter rensing med laser sammenlignet med SRP (12). Oppfølgingsstudien viste at etter 24 måneder var det ikke lenger signifikant forskjell mellom gruppene (13). Begge metodene gav en signifikant lommereduksjon og festegevinst etter både 12 og 24 måneder (13).
Bruk av fluorescens-kontrollert Er:YAG-laser ble sammenlignet med ultralydsrensing på 20 pasienter med avansert til moderat periodontitt etter «split-mouth design». Resultatene viste forbedring av alle kliniske parametre for begge gruppene etter 6 måneder, men ingen signifikant forskjell mellom gruppene (14).
I en seinere studie, ble Er:YAG-laser uten «feed-back» system sammenlignet med ultralydsrensing (15). Tjuefire pasienter med moderat til avansert kronisk marginal periodontitt ble behandlet etter «split-mouth design». Hver pasient måtte ha to kvadranter med minst fire tenner med sonderingsdybde på mer enn 4 mm. Pasientene ble kontrollert etter 3, 12 og 24 måneder. Begge behandlingene gav signifikant lommereduksjon og festegevinst ved alle kontrollene. En konkluderte videre med at for lommer ≥5 mm gav Er:YAG-laser en signifikant større lommereduksjon og festegevinst sammenlignet med ultralydsrensing (15).
Det er så langt bare publisert én studie som har sammenlignet Er:YAG-laser med ultralydsrensing på vedlikeholdspasienter (16). Tjue pasienter med moderat til avansert kronisk periodontitt ble behandlet etter «split-mouth design». Hver pasient måtte ha minst fire tenner (minst to i to kvadranter) med lommer på 4 mm eller mer. Pasientene ble kontrollert etter 1 og 4 måneder. Etter 1 måned var det signifikant større lommereduksjon og festegevinst i lasergruppen sammenlignet med kontrollgruppen. Etter 4 måneder var forskjellen ikke lenger signifikant. For begge gruppene ble det funnet reduksjon i subgingival mikroflora, men ingen signifikant forskjell mellom gruppene. Pasientene opplevde laserbehandlingen som signifikant mindre ubehagelig enn rensing med ultralyd (16).
Infeksjoner ved implantater
Det er bred enighet om at peri-implantatrelaterte sykdommer som mukositt og peri-implantitt er forårsaket av bakterier (17). Mens mukositt er en reversibel tilstand begrenset til bløtvevet, fører peri-implantitt til permanent tap av alveolært bein. Per dags dato finnes det ikke vitenskapelig dokumenterte behandlingsregimer for peri-implantitt. Tverrsnittsundersøkelser på pasienter behandlet med dentale implantater og med en observasjonstid på minst 5 år, viser at forekomsten av mukositt er ca. 80 % på individnivå (ca. 50 % på implantatnivå), mens peri-implantitt rammer 28 % til 56 % av individer og 12 % til 43 % av implantater (18 – 20). Dette indikerer at peri-implantatrelaterte sykdommer oppstår ofte etter implantatbehandling og vil kreve store ressurser i form av forebyggende og behandlende tiltak. Det er derfor viktig at det utarbeides forslag til behandlingsprotokoller og utprøves teknikker som kan være til hjelp for klinikeren ved slik behandling.
Et skrueformet design fremmer på lik linje med ulike overflatemodifiseringer biofilmansamling på eksponerte implantatoverflater og vanskeliggjør dessuten effektiv mekanisk rensing. Mens mekanisk ikke-kirurgisk behandling av mukositt kan være effektiv (21), ser dette ikke ut til å være tilfelle ved behandling av peri-implantitt (22). Økt overflateruhet på implantatet resulterer i økt plakkretensjon og kolonisering av bakterier, og dermed lettere utvikling av peri-implantitt (23). Hovedintensjonen med kirurgisk behandling av peri-implantitt er å få direkte tilgang til implantatoverflaten for å kunne utføre en effektiv rensing og dekontaminering, som postkirurgisk vil kunne gi fullstendig tilheling av den inflammatoriske lesjonen (17). Siden implantatoverflatene har en komplisert overflatestruktur, vil tradisjonell mekanisk rensing være umulig. Laserbehandlingen forutsetter imidlertid direkte kirurgisk tilgang til implantatoverflaten, slik at laserlyset treffer mest mulig vinkelrett på overflaten (Figur 3). Vinkles arbeidsspissen for skrått mot implantatet, vil renseeffekten reduseres på grunn av skyggevirkningen av gjengene.
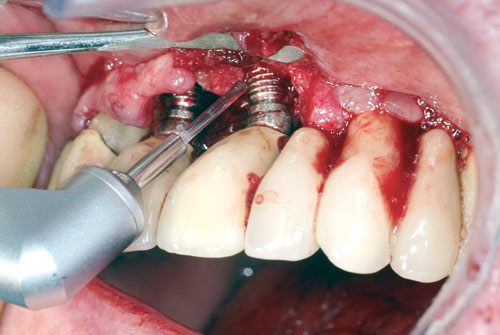
Figur 3. Laserbehandling av implantater regio 11 og 21.
Diskusjon
Det er omfattende dokumentasjon for at subgingival SRP gir generelt gode resultater ved behandling av periodontale sykdommer (24, 25). Imidlertid vil lokale anatomiske forhold som rotkonkaviteter, rotfurer, trangstilling og dype, trange lommer vanskeliggjøre tilgjengelighet, og dermed vil tradisjonell rensing kunne gi et usikkert behandlingsresultat. Dessuten utvikler ca. 10 % av den voksne befolkningen i vestlige land en alvorlig periodontal sykdom som er vanskelig å behandle ved ikke-kirurgisk så vel som ved kirurgisk terapi. Heller ikke lokal eller systemisk tilleggsbehandling med antibiotika har gitt ønsket effekt. En er derfor på stadig leting etter nye og bedre teknikker til effektivt å desinfisere periodontale lommer. Således er ulike lasertyper blitt lansert både som et supplement og som et alternativ til konvensjonell terapi.
Nd:YAG-laser har en kortere bølgelengde (1064 nm) som absorberes mindre av vann enn bølgelengdene fra CO2- og erbiumlasere, hvilket medfører at laserstrålen penetrerer dypere inn i dentalt hardvev (Tabell 1). Laserstråling fra Nd:YAG-laseren gir atskillig mer spredning i vevet og absorberes bedre i for eksempel pulpa og omkringliggende bløtvev enn Er:YAG og CO2-lasere (1). Er:YAG-laseren har potensiale til selektivt å fjerne tannstein (26), ha en effekt mot periopatogene bakterier (27) og til å inaktivere bakterietoksiner (28). Kliniske studier og kasusrapporter har dessuten vist at bruk av Er:YAG-laser ved ikke-kirurgisk periodontal behandling kan gi signifikant festegevinst (12, 29). Av aktuelle lasertyper ser således Er:YAG-laseren ut til å være mest velegnet ved periodontal behandling.
Generelt er det ved bruk av Er:YAG-laser registrert lite smerter og uventede komplikasjoner (16, 30, 31). I studien av Tomasi et al. (2006) ble det rapportert om signifikant mindre ubehag ved laserbehandling enn ved ultralydsrensing (16). Disse funnene indikerer at Er:YAG-laserinstrumentering gir lite ettersmerter og er et trygt alternativ ved behandling av infiserte tannkjøttslommer.
Peri-implantitt kan uten tidlig diagnose føre til tap av osseointegrering og implantat. Hygienevennlig utforming av suprakonstruksjon, instruksjon i daglig egeninnsats og regelmessig pasientoppfølgning er de mest effektive tiltak mot peri-implantatrelaterte infeksjoner. Den rue implantatoverflaten gjør at behandling av etablerte defekter gir et svært usikkert resultat. Det er derfor viktig i oppfølgningsfasen å benytte biologiske parametere, for eksempel lommeregistrering og blødning, som er i stand til å fange opp begynnende inflammatoriske vevsforandringer (32). Enkelte klinikere mener at lommesondering vil kunne skade barrieren rundt implantatet og dessuten inokulere bakterier submukosalt. En eksperimentell dyrestudie som undersøkte tilhelingen etter standardisert peri-implantatsondering med en kraft på 0,25 N (ca. 25 gram), observerte imidlertid full tilheling av den mukosale barriere allerede etter 5 dager (33). I dag er det generelt akseptert at lommesondering rundt implantater med «normal» kraft ikke skader vevet rundt implantatet. Prosedyren anbefales tvert imot som et viktig diagnostisk hjelpemiddel. Sonderingsdybder på 5 mm eller mer er en sterk indikator på begynnende peri-implantitt.
Blødning ved sondering er også en viktig diagnostisk parameter. En prospektiv klinisk studie som undersøkte den prognostiske verdien av blødning ved sondering rundt implantater i vedlikeholdsfasen, viste at implantater med blødning ved mer enn halvparten av kontrollene over en 2-års periode, utviklet festetap (34). På samme måte er puss ved sondering en verdifull parameter ved diagnostisering av peri-implantatrelaterte sykdommer (20, 35). Røntgenbilder blir i hovedsak brukt til å vurdere beinnivået rundt implantater og har sammen med mobilitet mindre verdi som diagnostisk hjelpemiddel ved tidlig sykdomsutvikling (32).
Mange klinikere har håpet på at lokal eller systemisk bruk av antibiotika ville være et nyttig hjelpemiddel ved behandling av peri-implantitt. Men i litteraturen er det svært usikre holdepunkter for at antibiotikabruk øker vellykkethetsprosenten, både ved ikke-kirurgisk og ved kirurgisk behandling av peri-implantitt (17).
Til nå er det utført svært få veldokumenterte studier der laser er brukt ved behandling av peri-implantatrelaterte infeksjoner. En studie konkluderte med at så mange som 58 % av peri-implantitt lesjonene viste stabil tilheling 5 år etter rensing med Er:YAG-laser (36). I tillegg er det indikasjoner i litteraturen på at rensing med Er:YAG-laser som et supplement til mekanisk instrumentering kan gi større grad av dekontaminering og re-osseointegrering enn tradisjonell rensing (37, 38).
Under innsetting av implantater og seinere rensing i vedlikeholdsfasen vil temperaturer på 47 til 50°C kunne resultere i nekrose av alveolært bein (38). Rensing av implantater må derfor på ingen måte utvikle varme som overstiger denne kritiske temperaturgrensen. In vitro så vel som in vivo studier indikerer at ved vanlig klinisk bruk vil rensing med Er:YAG-laser ikke gi temperaturer i overgangen mellom bein og implantat som overstiger 47°C (16, 38). Det er heller ikke rapportert om postoperative smerter eller hevelse ved bruk av Er:YAG-laser som indikerer problematisk varmeutvikling (4).
Alle autoriserte tannleger kan bruke lasere til pasientbehandling dersom bruken er berettiget. Selv om behandling med laser gir interessante perspektiver for klinikeren, er det fortsatt flere ubesvarte spørsmål som må utredes. Arbeidsspissene bør få en slankere og mer hensiktmessig utforming og de mest effektive energinivåer ved ulike behandlingsprosedyrer er heller ikke fastlagt. Kirurgisk tilnærming ser ut til å være mest effektiv ved behandling av peri-implantitt. Laserteknikken er under stadig utvikling og forbedring. Det er viktig å følge denne spennende utviklingen som sannsynligvis vil resultere i nye modeller med større behandlingspotensiale.
English summary
Laser treatment of periodontal and peri-implant infections
Laser therapy has for many years been a successful treatment approach in several areas of general medicine. A dental laser survey among general dental practitioners and specialists in periodontics in 2008, reported that 53 % of dentists and 36 % of specialists used lasers in their management of gum diseases. The numbers have to be interpreted with caution; nevertheless, laser therapy appears to be an increasingly common treatment option also in the dental clinic. Having in mind the rather aggressive marketing of lasers in the treatment of periodontal and peri-implant infections, this article aims to describe the mode of action and critically evaluate the merits of laser therapy.
Different types of lasers are available, but presently the Er:YAG laser seems to be most promising in dentistry. The main conclusion is that laser application in non-surgical periodontal and surgical peri-implantitis therapies provides no beneficial effect over traditional treatment procedures. With the wavelengths and power settings used, no major adverse effects have been reported for dental use of the Er:YAG laser. However, there is a need for broader basis of well-designed clinical trials for drawing definite conclusions about the long-term effect of laser treatment.
Leknes KN, Alstad ME, Bruzell E. Laserbehandling av infeksjoner ved tenner og dentale implantater. Nor Tannlegeforen Tid. 2009;119:700–6. doi:10.56373/2009-11-4
Takk
Takktil Ivar Krohn-Dale, Odontologisk klinikk, Rune Haakonsen, fototeknisk laboratorium, Inge Fristad og Nils Roar Gjerdet, Institutt for klinisk odontologi, UiB
Hovedbudskap | |
|---|---|
• |
Langtidsresultater av laserbehandling ser ikke ut til å ha en tilleggseffekt utover den effekten som en oppnår med tradisjonell periodontal behandling |
• |
Ved kirurgisk behandling av peri-implantitt kan rensing med Er:YAG-laser som et supplement til mekanisk instrumentering gi større grad av dekontaminering og re-osseointegrering |
• |
Laserbehandling oppleves av mange som mindre smertefullt enn tradisjonell rensing |
• |
Det er ikke rapportert om utilsiktede vevsskader etter odontologisk bruk av Er:YAG-laser |
• |
Alle autoriserte tannleger har anledning til å bruke lasere til pasientbehandling, men det forutsetter kjennskap til lasersikkerhet og at utstyret er meldt til Statens strålevern |
Referanser
1. Katzir A. Lasers and optical fibers in medicine. San Diego: Academic Press; 1993.
2. Blum R, Moritz A. Oral laser application. Berlin: Quintessenz; 2006.
3. Dederich DN, Bushick RD. Lasers in dentistry: separating science from hype. J Am Dent Assoc. 2004; 135: 204 – 12.
4. Ishikawa I, Aoki A, Takasaki AA. Potential applications of Erbium: YAG laser in periodontics. J Periodontal Res. 2004; 39: 275 – 85.
5. Moseley H. Laser-tissue interactions. In: Ferguson J, Dover JS, editors. Photodermatology. London: Manson; 2006. p. 135 – 140.
6. Moseley H. Operator error is the key factor contributing to medical laser accidents. Lasers Med Sci. 2004; 19: 105 – 11.
7. Parker S. Lasers and soft tissue: periodontal therapy. Br Dent J. 2007; 202: 309 – 15.
8. Miyazaki A, Yamaguchi T, Nishikata J, Okuda K, Suda S, Orima K, et al. Effects of Nd:YAG and CO2 laser treatment and ultrasonic scaling on periodontal pockets of chronic periodontitis patients. J Periodontol. 2003; 74: 175 – 80.
9. Schwarz F, Aoki A, Becker J, Sculean A. Laser application in non-surgical periodontal therapy: a systematic review. J Clin Periodontol. 2008; 35(Suppl): 29 – 44.
10. Schwarz F, Sculean A, Berakdar M, Georg T, Reich E, Becker J. Clinical evaluation of an Er:YAG laser combined with scaling and root planing for non-surgical periodontal treatment. A controlled, prospective clinical study. J Clin Periodontol. 2003a; 30: 26 – 34.
11. Derdilopoulou FV, Nonhoff J, Neumann K, Kielbassa AM. Microbiological findings after periodontal therapy using curettes, Er:YAG laser, sonic, and ultrasonic scalers. J Clin Periodontol. 2007; 34: 588 – 98.
12. Schwarz F, Sculean A, Georg T, Reich E. Periodontal treatment with an Er:YAG laser compared to scaling and root planing. A controlled clinical study. J Periodontol. 2001; 72: 361 – 7.
13. Schwarz F, Sculean A, Berakdar M, Georg T, Reich E, Becker J. Periodontal treatment with an Er:YAG laser or scaling and root planing. A 2-year follow-up split-mouth study. J Periodontol. 2003b; 74: 590 – 6.
14. Sculean A, Schwarz F, Berakdar M, Romanos GE, Arweiler NB, Becker J. Periodontal treatment with an Er:YAG laser compared to ultrasonic instrumentation: a pilot study. J Periodontol. 2004; 75: 966 – 73.
15. Crespi R, Cappare P, Toscanelli I, Gherlone E, Romanos GE. Effects of Er:YAG laser compared to ultrasonic scaler in periodontal treatment: a 2-year follow-up split-mouth clinical study. J Periodontol. 2007; 78: 1195 – 200.
16. Tomasi C, Schander K, Dahlen G, Wennstrom JL. Short-term clinical and microbiologic effects of pocket debridement with an Er:YAG laser during periodontal maintenance. J Periodontol. 2006; 77: 111 – 8.
17. Lindhe J, Meyle J. Peri-implant diseases: Consensus Report of the Sixth European Workshop on Periodontology. J Clin Periodontol. 2008; 35(Suppl): 282 – 5.
18. Fransson C, Lekholm U, Jemt T, Berglundh T. Prevalence of subjects with progressive bone loss at implants. Clin Oral Implants Res. 2005; 16: 440 – 6.
19. Roos-Jansåker A-M, Lindahl C, Renvert H, Renvert S. Nine- to fourteen-year follow-up of implant treatment. Part II: presence of peri-implant lesions. J Clin Periodontol. 2006; 33: 290 – 5.
20. Fransson C, Wennstrom J, Berglundh T. Clinical characteristics at implants with a history of progressive bone loss. Clin Oral Implants Res. 2008; 19: 142 – 7.
21. Porras R, Anderson GB, Caffesse R, Narendran S, Trejo PM. Clinical response to 2 different therapeutic regimens to treat peri-implant mucositis. J Periodontol. 2002; 73: 1118 – 25.
22. Karring ES, Stavropoulos A, Ellegaard B, Karring T. Treatment of peri-implantitis by the Vector system. Clin Oral Implants Res. 2005; 16: 288 – 93.
23. Miller R. Treatment of the contaminated implant surfaces using the Er, Cr: YSGG laser. Implant Dent. 2004; 13: 165 – 70.
24. Badersten A, Nilveus R, Egelberg J. Effect of nonsurgical periodontal therapy. I. Moderately advanced periodontitis. J Clin Periodontol. 1981; 8: 57 – 72.
25. Lindhe J, Westfelt E, Nyman S, Socransky SS, Haffajee AD. Long-term effect of surgical/non-surgical treatment of periodontal disease. J Clin Periodontol. 1984; 11: 448 – 58.
26. Folwaczny M, Mehl A, Haffner C, Benz C, Hickel R. Root substance removal with Er:YAG laser radiation at different parameters using a new delivery system. J Periodontol. 2000; 71: 147 – 55.
27. Ando Y, Aoki A, Watanabe H, Ishikawa I. Bactericidal effect of erbium YAG laser on periodontopathic bacteria. Lasers Surg Med. 1996; 19: 190 – 200.
28. Folwaczny M, Aggstaller H, Mehl A, Hickel R. Removal of bacterial endotoxin from root surface with Er:YAG laser. Am J Dent. 2003; 16: 3 – 5.
29. Watanabe H, Ishikawa I, Suzuki M, Hasegawa K. Clinical assessments of the erbium: YAG laser for soft tissue surgery and scaling. J Clin Laser Med Surg. 1996 ; 14: 67 – 75.
30. Ambrosini P, Miller N, Briancon S, Gallina S, Penaud J. Clinical and microbiological evaluation of the effectiveness of the Nd: Yap laser for the initial treatment of adult periodontitis. A randomized controlled study. J Clin Periodontol. 2005; 32: 670 – 6.
31. Kelbauskiene S, Maciulskiene V. A pilot study of Er,Cr: YSGG laser therapy used as an adjunct to scaling and root planing in patients with early and moderate periodontitis. Stomatologija. 2007; 9: 21 – 6.
32. Heitz-Mayfield LJ. Peri-implant diseases: diagnosis and risk indicators. J Clin Periodontol. 2008; 35(Suppl): 292 – 304.
33. Etter TH, Hakanson I, Lang NP, Trejo PM, Caffesse RG. Healing after standardized clinical probing of the perlimplant soft tissue seal: a histomorphometric study in dogs. Clin Oral Implants Res. 2002; 13: 571 – 80.
34. Luterbacher S, Mayfield L, Bragger U, Lang NP. Diagnostic characteristics of clinical and microbiological tests for monitoring periodontal and peri-implant mucosal tissue conditions during supportive periodontal therapy (SPT). Clin Oral Implants Res. 2000; 11: 521 – 9.
35. Roos-Jansåker A-M, Lindahl C, Renvert H, Renvert S. Nine- to fourteen-year follow-up of implant treatment. Part 1: implant loss and associations to various factors. J Clin Periodontol. 2006; 33: 283 – 9.
36. Leonhardt A, Dahlen G, Renvert S. Five-year clinical, microbiological, and radiological outcome following treatment of peri-implantitis in man. J Periodontol. 2003; 74: 1415 – 22.
37. Schwarz F, Jepsen S, Herten M, Sager M, Rothamel D, Becker J. Influence of different treatment approaches on non-submerged and submerged healing of ligature induced peri-implantitis lesions: an experimental study in dogs. J Clin Periodontol. 2006; 33: 584 – 95.
38. Kreisler M, Kohnen W, Marinello C, Gotz H, Duschner H, Jansen B, et al. Bactericidal effect of the Er:YAG laser on dental implant surfaces: an in vitro study. J Periodontol. 2002; 73: 1292 – 8.
Adresse: Knut N. Leknes, professor, dr.odont. Institutt for klinisk odontologi – periodonti, Det medisinsk-odontologiske fakultet, Universitetet i Bergen. E-post: knut.leknes@odont.uib.no
Artikkelen har gjennomgått ekstern faglig vurdering.
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Leknes KN, Alstad ME, Bruzell E. Laserbehandling av infeksjoner ved tenner og dentale implantater. Nor Tannlegeforen Tid. 2009;119:700–6. doi:10.56373/2009-11-4