Cytostatika og oral helse
Orale bivirkninger som følge av cytostatikabehandling er et omfattende problem hos kreftpasienter. Bivirkninger i munnhulen som oppstår etter cellegiftterapi viser seg å være dårligere kartlagt i litteraturen enn de som oppstår etter radioterapi. Av orale bivirkninger er mukositt den vanligste, og den oppleves ofte av pasientene som den mest smertefulle. Infeksjoner er også en hyppig komplikasjon. Disse kan være lokale eller systemiske og skyldes sopp, bakterier eller virus. Undersøkelser som kartlegger hvordan cytostatika virker inn på tannutviklingsforstyrrelser og karies, er i størst utstrekning gjennomført på barn. De viser en signifikant dårligere tannhelse, uttrykt ved DMFT, og klare utviklingsforstyrrelser som emaljeopasiteter og rotutviklingsforstyrrelser. Munntørrhet forekommer også ofte. Undersøkelser viser at akutte forandringer i både salivaflow og -sammensetning forekommer i behandlingsperioden. Varigheten av disse forandringene varierer fra pasient til pasient og med type cytostatika som er administrert. Smaksforstyrrelser er også utbredt. Orale komplikasjoner og symptomer kan kompromittere selve kreftbehandlingen og gir klart dårligere livskvalitet. Dette kan påvirke både remisjon av sykdom og overlevelse. For å kunne forebygge og lindre disse komplikasjonene for kreftpasienter, bør tannhelsepersonell i større grad integreres i det onkologiske behandlingsteamet.
En stadig større del av befolkningen rammes av kreft. Bedring i diagnostikk og behandling har bedret prognosen for mange krefttyper (1). Innen onkologisk behandling av kreftsykdommer vurderes strålebehandling og cytostatika som de viktigste behandlingsmodaliteter, men annen medikamentell behandling kan også være av betydning (2). Munnhulen er spesielt sårbar for direkte og indirekte toksiske effekter av cytostatika. Denne risikoen skyldes forhold som munnslimhinnens raske celleomsetning, dens komplekse mikroflora, spyttkjertelfunksjon og traumatisering av bløtvev ved normal oral funksjon. I motsetning til ved strålebehandling er orale bivirkninger av cytostatikabehandling lite beskrevet. Hovedmålet med cytostatikabehandling er å oppnå selektiv effekt på tumorceller. Dette er vanskelig fordi de biologiske prosessene som er nødvendig for en celles liv er de samme i alle celler, også de maligne. Dette gir et smalt terapeutisk vindu og derav ofte alvorlige bivirkninger (3). Vi ønsker med denne artikkelen å beskrive orale bivirkninger knyttet til cytostatikabehandling basert på litteratursøk og med kliniske eksempler fra Kjevekirurgisk avdeling og Avdeling for kreftbehandling og medisinsk fysikk, Haukeland universitetssykehus.
Materiale og metode
Denne ikke-systematiske artikkelen er basert på søk i PubMed med tanke på å kartlegge mulige orale bivirkninger ved cytostatikabehandling, samt å få et inntrykk av hva som finnes av publisert litteratur vedrørende temaet. Ved å benytte søkeord som «Chemotherapy AND oral health», «Chemotherapy AND side effects», «Chemotherapy AND dental health», «Chemotherapy AND mucositis», «Chemotherapy AND caries», «Chemotherapy AND infections», varierte antall treff fra 2–3000 til over 50000. Ved hjelp av MeSH-database (Medical Subject Headings) gjorde vi søkene mer presise. Basissøkene inneholdt alltid emneordene «chemotherapy» og «neoplasms», samt relevante søkeord som «administration and dosage», «adverse effects» og «toxicity». Til denne basisen ble det lagt til aktuelle orale bivirkninger med tilhørende søkeord. Antall treff i artikler for de ulike søkene varierte fra ca. 10 til 40. Etter å ha studert disse artiklene, gjorde vi en skjønnsmessig selektering av artikler som er referert til i denne artikkelen.
Resultat
Ut ifra kriterier beskrevet i Materiale og metode fant vi 10 artikler (Ref. 4–8 og 10–14) som ble inkludert i studien. Av disse var tre oversiktsartikler og én omhandlet forandringer hos barn. Orale bivirkninger som ble nevnt, var mukositt, infeksjoner, karies, mineraliseringsforstyrrelser, hyposalivasjon/xerostomi og smaksforstyrrelser. Vi viser også til egne erfaringer (9) samt andre kilder (1–3), og vi eksemplifiserer enkelte av tilstandene med pasienter undersøkt ved Kjevekirurgisk avdeling, Haukeland universitetssykehus (Figur 1–4).
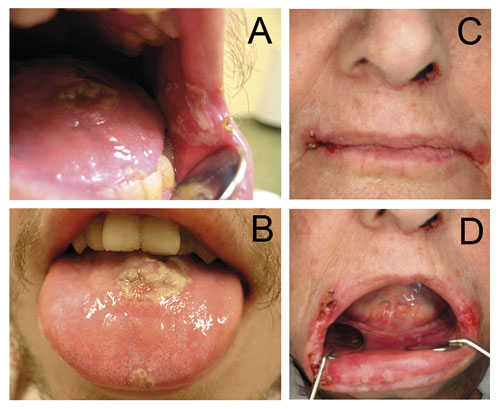
Figur 1. A og B: Mukosittlesjoner i kinnslimhinne og på tungen hos en 29 år gammel mann med kolorektalcancer med spredning til lever behandlet med 5-FU (fluorouracil). C og D: En 75 år gammel kvinne med sårhet på lepper og oral slimhinne etter cytostatikabehandling med Nitomycin og 5-FU mot analcancer.
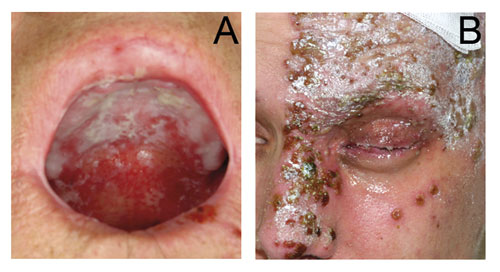
Figur 2. A: Candidainfeksjon hos en 71 år gammel mann etter cytostatikabehandling mot tykktarmskreft. B: Herpes zoster hos 20 år gammel mann under omfattende cytostatikabehandling mot osteosarkom.
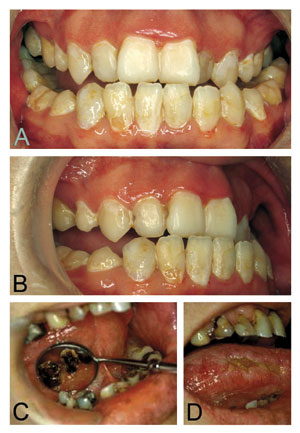
Figur 3. A og B: En 28 år gammel mann med tykktarmskreft med spredning. Det er begynnende kariesangrep og demineraliseringer. C: Alvorlig karies etter langvarig kjemoterapi. D: Cytostatikaindusert sår lateralt på tungen hos samme pasient som i C.
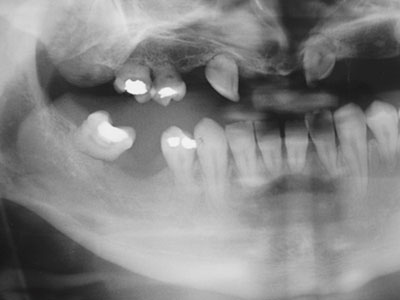
Figur 4. En 32 år gammel mann som i 3-årsalder ble behandlet med cytostatika over lang tid grunnet sarkom. Han fikk også strålebehandling mot deler av ansiktet. Det er multiple agenesier og svært korte tannrøtter. Kjevene er også betydelig underutviklet.
Oral mukositt
Munnhulen er et område hvor det ofte oppstår akutte komplikasjoner under aktiv kreftbehandling, og hvor kroniske komplikasjoner kan vedvare i lang tid etter behandlingen er avsluttet (4). Mukositt er den vanligste orale komplikasjonen ved bruk av cytostatika. Mukositt defineres som en inflammasjonsliknende prosess i oral mucosa og er en konsekvens av endringer i den epiteliale proliferisasjonen (2, 4). Mukositt starter vanligvis som et erytem, ofte i den bløte gane, på bukkalmucosa, tungens ventrale overflate og i munngulvet (Figur 1). Erytemet etterfølges av deskvamasjoner, og det kan oppstå ødemer gjerne lateralt på tungen og langs linea alba på bukkale mucosa (4). Oral mukositt kan gi kliniske konsekvenser som smerter, underernæring og både lokale og systemiske infeksjoner. Risikofaktorer for utvikling av mukositt deles inn i to kategorier; pasientrelatert og kjemoterapirelatert (Tabell 1, 2). Pasienter som har fått høydoseterapi, har beskrevet smertene i forbindelse med mukositt som den verste bivirkningen av cytostatika, også sammenlignet med andre, ikke-orale bivirkninger (5).
Pasientrelaterte risikofaktorer | |
|---|---|
Alder |
Det er en økt risiko for mukosittutvikling hos svært unge barn og hos eldre pasienter. Dette skyldes at unge har en økt celleproliferisasjon og eldre pasienter har en redusert tilhelingsrate. |
Kjønn |
Kvinner er noe mer utsatt enn menn. |
Oral helse og hygiene |
En ren og velholdt oral kavitet utvikler vanskeligere mukositt. |
Salivasekresjon |
Nedsatt salivasekresjon gir større mukosittproblemer. |
Genetikk |
Noen pasienter viser en økt resistent mot utvikling av mukositt. Ikke identifisert gen. |
Kroppsmasseindeks (BMI) |
Underernærte pasienter utvikler lettere mukositt. |
Røyking |
Røyking påvirker mikrosirkulasjonen og gir en redusert tilheling. |
Tidligere kreftbehandlet |
Økt risiko for pasienter som tidligere har utviklet mukositt ved kreftbehandling. |
Kjemoterapirelaterte risikofaktorer |
|
|---|---|
Spesifikke kjemoterapityper |
Metotrexate og 5-FU (fluorouracil) gir direkte mukosittlesjoner i munnslimhinne. |
Dose og administrasjonsregime |
Høy-dose cellegift administrert over en kort periode øker risikoen for utvikling sammenlignet med lav-dose over en lengre periode. |
Sykepleiere spiller en viktig rolle i behandling av mukositt. Mange steder er det denne yrkesgruppen som gir pasientene opplæring i oral helse, administrerer og gir farmakologiske hjelpemidler og hjelper pasientene å håndtere bekymringer tilknyttet mukositten (6). Ved enkelte kreftsentre, som ved Haukeland universitetssykehus, spiller tannpleiere en nøkkelrolle i behandling av oral mukositt, både som behandlere, men også som rådgivere til personalet ved sengepostene der den daglige oppfølgingen ofte foregår. Økt bruk av tannpleiere ved kreftsentre er også en trend internasjonalt.
Infeksjoner
Forandringer i oral mikroflora ved kreftbehandling kan føre til lokale og systemiske infeksjoner (Figur 2). Cytostatika har immunsuppresiv og cytotoksisk effekt og vil redusere munnslimhinnens forsvarsmekanismer ved å indusere epitelial atrofi, ulcerasjoner, redusert salivasekresjon og leukocytopeni. Dette kan føre til utvikling invasjon av mikroorganismer og økt risiko for systemiske infeksjoner, som hos denne pasientgruppen kan være livstruende (2, 7). En undersøkelse gjort på pasienter med akutt leukemi viste at 32,9% utviklet orale infeksjoner. Omtrent 50% av disse skyldtes sopp, 25% gramnegative bakterier, 15% herpes simplex virus og 10% grampositive kokker. De fleste infeksjonene oppstår under hospitalisering og er av opportunistisk karakter (nosokomialeinfeksjoner) (7).
Karies
Når det gjelder kariesproblematikk (Figur 3) og utviklingsforstyrrelser hos pasienter som har gjennomgått cytostatikabehandling, er dette lite kartlagt i litteraturen, og det lille som er gjort er gjort på barn. Avsar og medarbeidere påviste i en undersøkelse fra 2006, bestående av 96 barn med lymfom og sarkomdiagnoser behandlet med cytostatika, signifikante forskjeller mellom testgruppen og kontrollgruppen (8). Testgruppen viste at bare 18% av individene var kariesfrie, gjennomsnittlig DMFT var 7,75. I kontrollgruppen var 46% av individene kariesfrie og gjennomsnittlig DMFT på 4,21. I testgruppen hadde 69,8% emaljeforstyrrelser mot 19,8% i kontrollgruppen.
Av emaljeforstyrrelser ble det i begge grupper hyppigst diagnostisert hvitlige/gulaktige opasiteter i emaljen (49% i testgruppen; 13,5% i kontrollgruppen) etterfulgt av gulbrune opasiteter (13,5% i testgruppen; 4,2% i kontrollgruppen). Undersøkelser av emaljehypoplasier viste derimot ingen statistisk signifikante forskjeller mellom gruppene.
Den samme undersøkelsen viste også forskjeller vedrørende plakkindeks og stimulert salivaflow. Bufferkapasiteten så ut til å være lik hos de to gruppene, men antallet Lactobaciller og Streptococcus mutans var høyere i testgruppen enn i kontrollgruppen. I denne undersøkelsen fikk ingen av barna i testgruppen tilbud om fluorprofylakse (8). Det kan diskuteres hvorvidt det er kjemoterapi som er direkte årsak til økt kariesrisiko. Forhold som nedsatt oral hygiene og hyppigere inntak av kariogen kost i behandlingstidsrommet som følge av kjemoterapi er også viktige årsaksfaktorer (9). Enkelte andre undersøkelser på samme aldersgruppe hvor pasientene fikk et godt profylaktisk tilbud parallelt med cytostatikabehandlingen, viser ingen signifikante forskjeller på orale helseparametre. God utredning av tannstatus og profylakse vil derfor kunne begrense skadevirkningene av behandlingen.
Utviklingsforstyrrelser
Cytostatika forstyrrer cellesyklusen og den intracellulære metabolismen. Forandringer i ameloblastenes proliferasjon, sekretoriske funksjon, membranpermeabilitet og kalsiumutveksling gir en uregelmessig emaljeoverflate som kan sees klinisk som opak emalje. Flere kjemoterapeutiske agens kan forstyrre ameloblastenes mikrotubuli og kalsiumtransportmekanismer, og således føre til emaljedefekter (8). Samme undersøkelse viste at 52,1% i testgruppen hadde en for tidlig stanset rotutvikling med korte V-formede røtter, og 5,2% viste prematur apikal lukking (Figur 4). Bare 18,8% i kontrollgruppen viste noen form for rotanomalier. Den kliniske undersøkelsen viste at alle tenner med rotutviklingsforstyrrelser var eruptert i normalposisjon og uten periodontale sykdomstegn. Agenesier ble diagnostisert hos 20% av pasientene i testgruppen og 14,6% i kontrollgruppen. Forskjellen mellom de to gruppene var ikke statistisk signifikant (8).
Hyposalivasjon/xerostomi
Fra tidligere studier er det vanskelig å trekke absolutte konklusjoner angående hyposalivasjon hos pasienter under cytostatikabehandling, delvis fordi spekteret av cancerdiagnoser er mangfoldig og valg av type cytostatika og dose varierer. Det finnes flere undersøkelser som viser forandringer i både salivaflow og -sammensetning under cytostatikabehandling, men det finnes få undersøkelser som vurderer hvorvidt forandringene er temporære eller permanente (11). I en undersøkelse fra 2006 ble salivaflow og -sammensetning av stimulert og ustimulert helsaliva, samt stimulert parotis-saliva undersøkt på en gruppe brystkreftpasienter som ble behandlet med kjemoterapi (10). Målingene ble utført før, under, et halvt år og et år etter behandling. Funnene ble sammenlignet med resultatene i en kontrollgruppe bestående av brystkreftpasienter hvor kjemoterapi ikke var en del av behandlingen. Både ustimulert og stimulert saliva avtok under behandlingen. Ustimulert saliva var også lav etter 6 måneder, men var etter ett år på samme nivå som før behandlingen. Det ble ikke funnet statistisk signifikante forskjeller i målt stimulert parotissaliva mellom gruppene. Dette kan tyde på at den reduserte mengden helsaliva skyldes redusert sekresjon i submandibulære spyttkjertler. Hos 44% av pasientene var det hyposalivasjon med en ustimulert sekresjon <0,1 ml/min eller en stimulert sekresjon <0,5 ml/min. Pasientenes følelse av munntørrhet ble også kartlagt. Xerostomi-skår var økende under kjemoterapibehandlingen og var fremdeles høy ett år etter behandlingen. Salivas sammensetning viste også forskjeller mellom de to gruppene. En lett økning i natrium- og klorinnholdet, samt en redusert mengde uorganiske kationer ble registrert. En fant også at mengde protein og sekretorisk IgA var redusert i testgruppen sammenlignet med kontrollgruppen (10).
Det er gjort få undersøkelser hvor en har kartlagt histologiske endringer på spyttkjertelvev som følge av cytostatikabehandling. Biopsier fra pasienter behandlet for solide svulster og hematologisk kreft viste histologiske endringer i 50% av snittene. Det ble funnet dilaterte ductusceller og cystedannelse i selve kjertelvevet. Det ble også observert acini-degenerasjon og inflammasjonsinfiltrat i de mindre spyttkjertlene (11).
Smaksforstyrrelser
Mange pasienter som gjennomgår stråle- og/eller kjemoterapi opplever forandringer i smakssansen, både redusert (ageusia) og endret (dysgeusia) smakssans, noe som kan ha klar innflytelse på pasientenes livskvalitet. Kjemoterapi i seg selv kan gi umiddelbare smaksopplevelser; enkelte pasienter klager over en bitter smak under administreringen av det cytotoksiske middelet. Selv om disse smaksopplevelsene oftest bare varer fra noen få timer til noen dager, er det rapportert at disse forandringene har vedvart i uker og til og med i måneder (12). Problemer knyttet til smaksforstyrrelser har en sammenheng med hyposalivasjonen disse pasientene opplever.
Profylakse
Oral helse er en viktig faktor for menneskers velvære og spiller en viktig rolle ved tale og næringsinntak. I tillegg fungerer mucosa som et førstelinjeforsvar for infeksjoner i munnhulen. Munnhuleproblemer som oppstår i forbindelse med kreftbehandling, kan til en viss grad lindres eller forebygges. Det er derfor viktig at pasienter, pårørende og pleiepersonell har nødvendig kunnskap om dette.
Odontologiske tiltak før behandlingsstart bør inneholde vurdering av tenner, proteser og tannkjøtt. Sanering av infeksjonsfoci innebærer nødvendige ekstraksjoner, endodontisk og konserverende behandling. Gingiva bør være mest mulig fri for inflammasjon ved at tannstein fjernes og at det instrueres i god pusseteknikk. Under behandlingen bør pasienten ha mulighet for lindrende og forebyggende munnpleie (13, 14). Hvilke tiltak som treffes, må avgjøres individuelt da det er store individuelle variasjoner mellom pasienter som gjennomgår samme behandlingsregime, og forsøk på å finne universelle retningslinjer for lindrende behandling har så langt ikke lyktes (15, 16) Munnhygieneprogrammet bør inneholde prosedyrer for gode munnhygienerutiner inkludert anbefalt fluorbruk, råd ved munntørrhet og sår munn, samt kostholdsveiledning. Hvorvidt det er indikasjon for profylaktisk infeksjonsbyggende behandling på generell basis, er usikkert, og store, systematiske metaanalyser har ikke gitt klare konklusjoner (16, 17).
Diskusjon og konklusjon
I moderne kreftbehandling blir kjemoterapi benyttet både som ledd i kurativ behandling og som lindrende og livsforlengende behandling. De fleste cytostatika virker direkte eller indirekte på DNA eller på selve celledelingsprosessen og fører til celledød. Cancerceller er i de fleste tilfelle mer følsomme for cytostatika enn andre celler, noe som utnyttes terapeutisk. Bivirkninger som oppstår pga. skader på normale celler er imidlertid en begrensende faktor.
Kombinasjoner av ulike cytostatika er et dominerende prinsipp i dagens behandlingsregimer. Med kombinasjonsbehandling oppnår en additiv, muligens også synergistiske effekter, noe som kan begrense bivirkninger i forhold til effekt. Dette oppnås ved å kombinere ulike cytostatika som har ulik toksisitet på normale celler. Kombinasjonsbehandling vil også redusere risikoen for utvikling av resistens (3).
I hvor stor grad slimhinnene i munnen blir affiserte, er avhengig av hvilke typer cellegift som benyttes, hvilke doser som gis og administrasjonstiden. Typiske eksempler på mukosittinduserende preparater er høydose Metotrexat som eksempelvis blir gitt ved sarkomer og lymfomer, samt 5-FU (fluorouracil) som blir benyttet i behandling av flere ulike krefttyper. Disse stoffene medfører direkte skade på slimhinnen. I tillegg vil kjemoterapi generelt kunne ha flere uheldige virkninger på oral helse blant annet på grunn av kvalme og brekninger, dårlig matlyst og problemer med å gjennomføre tannpuss (9). Mukosittsymptomene kan også forverres av sekundærinfeksjoner som candidose fordi pasienter som får kjemoterapi, er langvarig immunkompromitterte.
Cellegiftbehandling representer på mange måter en tid der «alt går galt» sett med tannlegens øyne. Pasientene blir såre i munnen og plaget med kvalme. Som en følge av dette spiser de mer usunt, får brekninger med påfølgende erosjonsproblematikk og etseskader, og de orker heller ikke pusse tennene på grunn av smerter og kvalmefølelse. Slike munnhuleplager kan være av nesten invalidiserende art. Orale symptomer og komplikasjoner kan også kompromittere selve kreftbehandlingen, gi dårligere livskvalitet og føre til sosial dysfunksjon (2). Det er imidlertid dårlig kartlagt hvorvidt orale bivirkninger som f.eks. munntørrhet er av varig karakter eller i hovedsak er problematisk så lenge behandlingen varer. Flere studier på dette synes derfor nødvendig.
For å kunne forebygge og lindre orale komplikasjoner på en best mulig måte, bør tannhelsepersonell i større grad integreres i det onkologiske behandlingsteamet (13). Dette vil også kunne forebygge irreversible skader som karies og gi pasienten en høyere livskvalitet gjennom behandlingen. Ideelt sett bør nødvendig tannbehandling være ferdig før oppstart av cytostatikabehandling, og pasienten bør videre følges nøye av tannhelsepersonell gjennom behandlingen, særlig de pasientene som gjennomgår langvarig behandling. Dette kan imidlertid være problematisk da disse pasientene ofte har nedsatt funksjon og dessuten i perioder er særlig utsatte for infeksjoner og av den grunn ikke bør oppsøke et tannlegekontor. Grundig rådgivning og informasjon kan imidlertid avhjelpe mange av de mest alvorlige problemene.
English summary
Cancer chemotherapy and oral health
The incidence of cancer diseases in the population is increasing. Advancements in cancer diagnostics and therapy have improved the outcome for several of these patients. Apart from surgery, cancer is mainly treated with radiation or chemotherapy. Oral side-effects are well described related to radiotherapy, but only limited information is available concerning cancer chemotherapy. This review of literature address some common oral side-effects described in conjunction with this kind of treatment. Oral mucositis seems to be the most common side-effect, and also often the most painful complication overall for cancer chemotherapy. Infections, developmental disturbances, xerostomia, and dental decay are other adverse effects. The severity of these side-effects is dependent of several patient-related and drug-related factors. In addition to impaired oral health, discomfort, and impaired quality of life, the described side-effects may also compromise cancer treatment and prognosis. Dental screening before chemotherapy and close follow-up may improve the patients’ quality of life and prevent permanent damage to the oral environment.
Skår R, Løes IM, Thorsen L, Afnan S, Løes S. Cytostatika og oral helse. Nor Tannlegeforen Tid. 2010;120:968–73. doi:10.56373/2010-14-12
Hovedbudskap | |
|---|---|
• |
Kreftbehandling med cytostatika kan gi alvorlige orale bivirkninger |
• |
Orale bivirkninger kan i tillegg til de lokale plagene også kompromittere selve kreftbehandlingen |
• |
Spesiell oppfølging fra tannhelsepersonell bør iverksettes hos pasienter som skal gjennomgå langvarig cytostatikabehandling |
Referanser
1. Verdecchia A, Guzzinati S, Francisci S, De Angelis R, Bray F, Allemani C, Tavilla A, Santaquilani M, Sant M; EUROCARE Working Group. Survival trends in European cancer patients diagnosed from 1988 to 1999. Eur J Cancer. 2009; 45: 1042–66.
2. Herlofson BB, Løken K. Hvordan påvirkes munnhulen av kreftbehandling? Tidsskr Nor Lægeforen 2006; 126: 1349–52.
3. Christoffersen T, Fluge Ø, Lehne G, Dahl O. Kreftceller og kjemoterapi. In: Dahl O, Lehne G, Baksaas I, Christoffersen T, editors. Cytostatikaboken. 7utg. Oslo: Farmakologisk institutt, Universitetet i Oslo; 2009. p. 13–37.
4. Carl W. Oral complications of local and systemic cancer treatment. Curr Opin Oncol 1995; 7: 320–4.
5. Eilers J, Million R. Prevention and management of oral mucositis in patients with cancer. Semin Oncol Nurs. 2007; 23: 201–12.
6. Harris DJ, Eilers J, Harriman A, Cashavelly BJ, Maxwell C. Putting evidence into practice: Evidence-based interventions for the management of oral mucositis. Clin J Oncol Nurs. 2008; 12: 141–52.
7. Dreizen S, Bodey GP, Valdivieso M. Chemotherapy-associated oral infections in adults with solid tumors. Oral Surg Oral Med Oral Pathol. 1983; 55: 113–20.
8. Avsar A, Elli M, Darka Ö, Pinarli G. Long-term effects of chemotherapy on caries formation, dental development, and salivary factors in childhood cancer survivors. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2007; 104: 781–9.
9. Afnan S, Monge O, Thorsen L, Størksen K, Løes S. Chemotherapy may induce dental decay in sarcoma patients [abstract]. The 33rd Meeting of the Scandinavian Sarcoma Group, Bergen, Norway, May 2007.
10. Jensen SB, Mouridsen HT, Reibel J, Brünner N, Nauntofte B. Adjuvant chemotherapy in breast cancer patients induces temporary salivary gland hypofunction. Oral Oncol. 2008; 44: 162–73.
11. Jensen SB, Pedersen AM, Reibel J, Nauntofte B. Xerostomia and hypofunction of the salivary glands in cancer therapy. Support Care Cancer. 2003; 11: 207–25.
12. Comeau TB, Epstein JB, Migas C. Taste and smell dysfunction in patients receiving chemotherapy. Support Care Cancer. 2001; 9: 575–80.
13. Rosenberg SW. Oral care of chemotherapy patients. Dent Clin North Am. 1990; 34: 239–50.
14 Solomon C, Arendorf T, Shaikh A, Mills G. Benzydamine hydrochloride (Andolex) improves oral mucosal health in the immunocompromised patient. S Afr Med J. 1996; 86: 1566.
15. Clarkson JE, Worthington HV, Furness S, McCabe M, Khalid T, Meyer S. Interventions for treating oral mucositis for patients with cancer receiving treatment. Cochrane Database Syst Rev. 2010; 8: CD001973.
16. Hong CH, Napeñas JJ, Hodgson BD, Stokman MA, Mathers-Stauffer V, Elting LS, Spijkervet FK, Brennan MT et al. A systematic review of dental disease in patients undergoing cancer therapy. Support Care Cancer. 2010; 18: 1007–21.
17. Worthington HV, Clarkson JE, Khalid T, Meyer S, McCabe M. Interventions for treating oral candidiasis for patients with cancer receiving treatment. Cochrane Database Syst Rev. 2010; 7: CD001972.
Adresse: Sigbjørn Løes, Kjevekirurgisk avdeling, Haukeland Universitetssykehus, 5021 Bergen. E-post: sigbjorn.loes@odont.uib.no
Kreft; Livskvalitet; Bivirkning; Oral medisin
Artikkelen har gjennomgått ekstern faglig vurdering.
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Skår R, Løes IM, Thorsen L, Afnan S, Løes S. Cytostatika og oral helse. Nor Tannlegeforen Tid. 2010;120:968–73. doi:10.56373/2010-14-12