Genetisk test hos tandlægen?
professor, dr.odont., ph.d., odont.dr. (h.c.). Afdeling for Parodontologi, Odontologisk Institut, Det Sundhedsvidenskabelige Fakultet, Københavns Universitet
professor, odont.dr. Avdeling för Parodontologi, Institutionen för Odontologi, Sahlgrenska Akademin, Göteborg Universitet
lektor, ph.d. Afdeling for Oral Biologi, Odontologisk Institut, Health, Aarhus Universitet
I artiklen omtales geners mulige betydning for udviklingen af marginal parodontitis, og det konkluderes, at der ikke eksisterer en genetisk test, der kan anvendes til at bedømme det enkelte individs risiko for stor parodontal sygdomsaktivitet. Dermed er det med den aktuelle viden naturligvis ikke i overensstemmelse med god klinisk praksis at tilbyde gennemførelse af gentest til patienterne. Ligeledes omtales genetisk test af den subgingivale mikroflora, og det konkluderes, at en genetisk test af subgingivale bakterier kun tilfører en beskeden information, hvis nytte - med mulig undtagelse af visse befolkningsgrupper af afrikansk oprindelse - er meget begrænset. De etiske problemer knytter sig til sygeliggørelse af raske personer, til etablering af frygt og til betaling for en ydelse, der savner fagligt grundlag.
Med den genteknologiske udvikling er der åbnet muligheder for afdækning af genetiske variationer i forbindelse med sygdom. I kølvandet på denne udvikling opstår det naturlige spørgsmål, om man ved undersøgelse af genkompositionen hos det enkelte individ kan bestemme tilbøjeligheden til udvikling af en given sygdom eller til givne sygdomsforløb. Der rejser sig herved en række etiske temaer, der allerede for en del år siden havde pressens bevågenhed (1,2). I nærværende artikel søges nogle af de etiske problemstillinger kort belyst med fokus på marginal parodontitis.
Som en del af problemstillingen er det væsentligt at forstå, hvordan gener kan have betydning for sygdomsudviklingen, hvorfor dette gennemgås nedenfor.
Da parodontitis forårsages af bakterier i tandplak, og eftersom forskellige bakterier kan have forskelligt patogent potentiale, kunne analyse af plakkens sammensætning ved undersøgelse af bakteriernes gener også tænkes at være nyttigt. Relevansen heraf diskuteres kort.
Sammenhængen mellem genkomposition og sygdom
For en lang række sygdomme er det velkendt, at arvelighed indgår som en komponent i sygdommens ætiologi og patogenese, og det kan ikke undre, at den markante inter-individuelle forskel i fæstetabsudvikling og respons på behandling hos parodontitispatienter med sammenlignelig plakerfaring er søgt forklaret ud fra genetisk betingede forskelle i det immunologiske respons på bakterierne. De senere årtiers væsentlige fremskridt i forståelsen af genernes betydning har således medført et øget indblik i reguleringen af værtsresponset ved infektion. Det står klart, at genomet i høj grad kontrollerer de talrige interaktioner mellem inflammationsprocessens mange komponenter, og man har derfor forsøgt at identificere forskelle i de gener, som kunne tænkes at have betydning for forløbet af den parodontale infektions- og inflammationsproces. Betydningen af denne forskning understreges af, at ændringer i DNA-molekylets nukleotidsekvenser vil kunne nedarves og således resultere i arvelige forskelle i sygdomstilbøjelighed.
Inter-individuel variation i nukleotidsekvensen et bestemt sted i DNA''et betegnes genetisk polymorfi. Hvis forskellen kun involverer et enkelt nukleotid, tales om «single nucleotide polymorphism» - SNP (3). Hvis den pågældende polymorfi forekommer på begge kromosomparrets dele, er genotypen homozygot, mens en heterozygot genotype indebærer, at den kun forekommer på det ene af kromosomerne i et kromosompar. Ændringer i DNA-sekvenser kan opstå i forbindelse med celledeling, enten spontant eller som følge af kemisk eller strålemæssig påvirkning. Ændringer i DNA-sekvenser kaldes også mutationer, om end denne betegnelse oftest anvendes om ændringer, der medfører sygdom.
Opdagelsen af de genetiske polymorfier har stimuleret forskere til at identificere «kandidat-gener» med betydning for udvikling af medicinske og odontologiske sygdomme. Kandidat-genernes forekomst er blevet undersøgt i patientgrupper med bestemte sygdomme sammenlignet med raske kontrolgrupper, idet der derved kan opnås et indtryk af, om der er sammenhæng mellem de enkelte polymorfier og sygdommene.
De genetiske polymorfier, der især har interesse, viser sig ved sekvensforskelle i gener, der koder for syntetiserede proteiner og cellulære receptorer, der er involveret i de inflammatoriske processer. Ikke kun marginal parodontitis, men også talrige andre sygdomme har multifaktoriel baggrund. Der er derfor søgt efter forklaringer på en lang række kroniske inflammatoriske sygdomme i samspillet mellem gener og omgivelser. Det har i den forbindelse overraskende vist sig, at sygdomme så forskellige som fedme og astma har ligheder på det molekylære og cellulære plan (4). Der er således identificeret adskillige sygdomsrelaterede polymorfier, der kan tænkes at forklare dele af de reaktionsforskelle, som betinger individets tilbøjelighed til disse og andre sygdomme. Imidlertid tyder undersøgelser på, at de enkelte geners betydning for udvikling af sygdom er begrænset. Det har fx vist sig, at sygdomsassocierede gener kun står for 1 % af arveligheden for type 2-diabetes til trods for, at arvelighedsundersøgelser har vist, at nære slægtninge med type 2-diabetes indebærer en 3 - 4 gange øget risiko for at få sygdommen (5 - 7). Der synes således ikke at være nogen simpel sammenhæng mellem genkomposition og individuel tilbøjelighed til sygdom.
Dette indebærer fx, at en genetisk test for identifikation af sygdomstilbøjelighed ved type 2-diabetes er nytteløs (4). Det betyder dog ikke, at de enkelte sekvensforskelle i gener, der er relateret til det immunologiske respons, er uden betydning for sygdomsudviklingen, men der ligger formentlig en kombination af en lang række sekvensforskelle bag det, der i klinikken opleves som forskellig tilbøjelighed til sygdom (4).
I den forbindelse er det vigtigt, at ikke alle genetiske forskelle nødvendigvis kommer til udtryk i det enkelte individ. Mekanismer uden for generne, betegnet epigenetiske mekanismer, er således afgørende for, om generne bliver gjort tilgængelige og aflæst. For yderligere uddybning vedr. epigenetik kan henvises til (8). Det betyder, at om end en given genetisk forskel er til stede i de celler, der har betydning for det immunologiske respons, er det ikke sikkert, at denne forskel kommer til udtryk i den inflammatoriske proces. Forskelle i de epigenetiske mekanismer er dermed også afgørende for cellernes reaktionsmønstre, og miljøfaktorer kan påvirke de epigenetiske mekanismer. Dermed spiller også miljøfaktorer en betydelig rolle for den individuelle sygdomstilbøjelighed (9). Disse miljøfaktorer kan fx være mikroorganismer, ernæringsforhold og tobak. Det er således beskrevet, at hungersnød i fostertilstanden har medført blivende arvelige epigenetiske ændringer (10), og epigenetiske forskelle er dermed blevet forklaret som bindeleddet mellem generne, miljøet og fænotypeudviklingen, herunder udviklingen af en given sygdom (4).
Sammenhængen mellem genkomposition og marginal parodontitis
En netop offentliggjort amerikansk undersøgelse (NHANES) har vist en prævalens af marginal parodontitis på over 47 % hos personer over 30 år. Sygdommen fordelte sig med 8,7 %, 30 % og 8,5 % i grupperne let, moderat og svær, henholdsvis (11). Parodontitis er således ikke blot en af de hyppigste sygdomme i mundhulen, men også en af de hyppigste sygdomme i mennesker i det hele taget. Til trods for dette og den viden, der eksisterer om sygdommens bakterielle ætiologi, ved vi i dag fortsat ikke i detaljer, hvorfor nogle individer rammes hårdere af parodontitis end andre. Introduktionen af genetisk test til identifikation af polymorfier, der måske kunne begrunde særlig tilbøjelighed til parodontal nedbrydning, skabte på den baggrund betydelig optimisme for 15 år siden (12).
Idet der henvises til en nylig publikation om marginal parodontitispatogenese i Tandlægebladet (13) for en nærmere gennemgang af sygdommens patogenetiske aspekter, blev det, som nævnt i denne artikel, allerede for mange år siden erkendt, at især defekter, der involverer fagocytternes antal og funktion (14), indebærer en stærkt forøget risiko for at udvikle aggressiv marginal parodontitis. Flere af de involverede sygdomme, fx Papillon-Lefèvres syndrom, vides at være monogenetisk arvelige, dvs. de kan henføres til mutationer i et enkelt gen (se nedenfor). Tidlige studier af marginal parodontitisnedarvning inden for familier har imidlertid antydet, at også former for marginal parodontitis, der ikke er relateret til sådanne sygdomme, kan vise tegn på arvelighed (15). I tvillingestudier blev det således vist, at halvdelen af sygdomsvariationen ved marginal parodontitis kunne forklares ud fra genetiske forhold. Ligeledes er der konstateret familiær ophobning i studier af unge individer med aggressiv parodontitis (16,17). På den baggrund har omfattende nyere forskning vist, at marginal parodontitis er delvist arvelig med baggrund i en lang række forskellige gener af betydning for immunreaktioner.
Mens immundefekter som led i syndromer som regel kan henføres til et enkelt sygdomsgen med stor penetrans, medfører hver enkelt variant for de ikke-syndromassocierede modifikationer af immunsystemet kun en begrænset øgning af sygdomsrisikoen (odds-ratio ca. 1,5 - 3,0) (18). Endvidere har risikogener identificeret i en bestemt population ikke altid kunnet genfindes ved undersøgelser af andre etniske grupper. De foreliggende undersøgelser tyder således på, at marginal parodontitis kan være knyttet til defekter forskellige steder i immunsystemet, men formentlig skal flere led være ændret, før tilbøjeligheden til sygdommen øges. Endvidere synes forskellige kombinationer af risikogener at kunne føre til øget sygdomsrisiko, hvilket bl.a. fremgår af flere oversigtsartikler om emnet (18,19). Kompleksiteten af de genetiske variationer, der kan øge risikoen for marginal parodontitis, medfører formentlig sygdomstilbøjelighed på mange forskellige niveauer.
Cytokinerne har pga. deres betydning for inflammationsprocessen medført betydelig interesse. Individuelle forskelle i deres syntese kunne måske forklare en del af den store variation i tilbøjeligheden til sygdomsaktivitet. I den forbindelse har der været fokuseret på genetisk polymorfi i de gener, der koder for inflammatoriske cytokiner, fx IL-1 (20), IL-6 (21) og IL-10 (22 - 25) og deres antagonister (26).
I et pionerstudie af Kornman og medarbejdere (12) blev forekomsten af fem polymorfier relateret til svær, moderat og let forekomst af marginal parodontitis undersøgt. Fire af polymorfierne havde relation til gruppen af interleukin (IL)-1-relaterede gener, og en havde relation til Tumor Necrosis Factor (TNF). Ingen af disse enkelte polymorfier viste signifikant øget hyppighed i patientgrupperne, men en kombination af to af de undersøgte polymorfier (IL1A -889 og IL1B +3953) blev konstateret særligt hyppigt forekommende hos ikke-rygende patienter med svær parodontitis (12). Genkombinationen (haplotypen) blev efterstående undersøgt i associationsstudier af genetisk polymorfi og marginal parodontitis. Den var imidlertid positiv hos omkring 1/3 af befolkningen, og så mange patienter har, som bekendt, ikke svær eller aggressiv parodontitis. Endvidere var sammenhængen til IL-1-gener ikke påviselig hos rygere, måske som udtryk for, at rygning som risikofaktor overdøvede IL-1-genvarianter. Andre undersøgelser har vist varierende resultater, og den funktionelle relevans af haplotypen er ikke afklaret.
Mange andre studier af forskellige genetiske polymorfier og parodontitis er udført efterstående. Et af de generelle problemer med disse studier er manglende statistisk styrke pga. små undersøgelsesgrupper. Det er således blevet nævnt, at studier af denne type kan kræve flere tusind patienter for at opnå bæredygtige resultater (27). En omfattende ny oversigtsartikel har sammenfattet resultaterne af kandidat-gen-undersøgelser med mindst 100 involverede parodontitispatienter (28). I undersøgelserne indgik ovennævnte haplotype og andre cytokin-relaterede kandidat-gener (TNFA, IL4, IL6, IL10), gener relateret til Fc-gamma receptorer (Fc?R), der er vigtige for iværksættelse af fagocytose af bakterier, og vitamin D receptor-gener (VDR). Gener, der er relateret til det innate immunforsvar, er ligeledes undersøgt, herunder polymorfier med relation til matrixmetalloproteinase (MMP) 1 og især Toll-like receptors (TLR), der er afgørende for iværksættelse af det innate og dermed også det adaptive immunforsvar (28). Laine et al. (28) understregede, at der er store variationer i genotypefrekvenser mellem forskellige populationer, hvorfor etnicitet må indgå i vurderingen af eventuelle kandidat-gener.
Et af de problemer, der fremgår af undersøgelserne, er de anvendte sygdomsklassifikationer, herunder definitioner af aggressiv og kronisk parodontitis, der varierer. Det blev konkluderet, at der kan være associationer mellem aggressiv parodontitis og polymorfier i generne IL1B, IL1RN, Fc?RIIIb, VDR og TLR4. Tilsvarende kan der være associationer mellem kronisk parodontitis og IL1B, IL1RN, IL6, IL10, VDR, CD14,TLR4, og MMP1 polymorfier. På baggrund af disse fund er der udviklet metoder til gentest af patienter med henblik på forudsigelse af stor tilbøjelighed til destruktiv marginal parodontitis. Da nogle klinikker, som det bl.a. fremgår ved søgning på internettet, gør brug heraf, er det dog vigtigt at understrege, at der ikke ved nogen kendt gentest kan forudsiges noget om risiko for stor sygdomsaktivitet i forbindelse med marginal parodontitis (29 - 32).
Ved studier af specielle kandidat-geners sammenhæng med marginal parodontitis sker en selektion i udvælgelsen af de undersøgte gener, og hidtil ukendte kandidat-gener kan måske overses. Yderligere udvikling af forskningen har ved screening af hele det menneskelige genom givet mulighed for at erkende genetisk sammenhæng med sygdomme i mere omfattende analyser. Sådanne undersøgelser, betegnet «genome-wide association studies» (GWAS), har været anvendt ved studier af flere systemiske sygdomme, herunder type 2-diabetes, hjerte-kar-sygdom og osteoporose (33,34), og må forventes at kunne kaste yderligere lys over genetikkens betydning for marginal parodontitis. Der er foreløbig kun få af denne type studier inden for odontologi, men en associationsundersøgelse af 1.758 individer med aggressiv parodontitis eller sunde parodontale forhold har medført identifikation af en SNP med relation til marginal parodontitis, lokaliseret i glycosyltransferase-genet, GLT6D1. Den funktionelle betydning af denne SNP er dog ukendt (35).
Andre mutationer kan som nævnt forekomme i et enkelt gen og derved manifestere sig ved opståen af monogenetiske syndromer, der nedarves if. Mendels love. Flere af disse sygdomme kan præsentere sig i mundhulen, fx sygdomme med defekter i de neutrofile granulocytters antal og funktion (36). Et eksempel er Papillon-Lefèvres syndrom, der er karakteriseret ved svær aggressiv parodontitis og sår i mundhulen. Da der ikke er muligheder for at behandle den genetiske baggrund for sygdommen, indebærer behandlingsstrategien for marginal parodontitis en forstærket indsats med infektionskontrol. Baggrunden for Papillon-Lefèvres syndrom er en mutation i cathepsin C-genet. Cathepsin C er en vigtig lysosomal protease med specifik betydning for de neutrofile granulocytters funktion ved at aktivere proenzymer og ved eliminering af patogener og rekruttering af andre leukocytter (37,38). Defekten i genet ved Papillon-Lefèvres syndrom medfører således beskadiget funktion af de neutrofile granulocytter, hvorved infektionsmodstanden reduceres. Sygdommens manifestationer viser sig allerede i tidlig barnealder med hurtigt progedierende marginal parodontitis i mælketandsættet og efterstående i det permanente tandsæt (Fig.1). Om end der gøres alt for infektionskontrollen hos disse patienter, er prognosen for tænderne yderst tvivlsom. Flere andre monogenetisk betingede former for parodontitis er beskrevet (18).
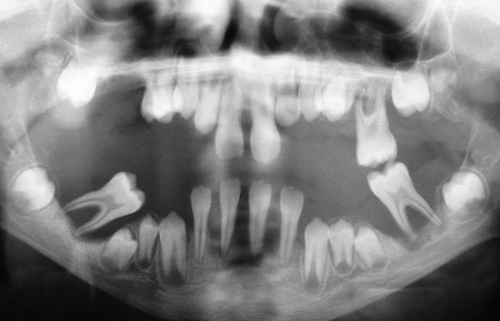
Fig. 1. Ortopantomogram af 11-årig dreng med Papillon-Lefèvres syndrom. Den udtalte marginale parodontitis har afficeret såvel mælketandsættet som de permanente tænder.
Etiske overvejelser om gentest af patienter med marginal parodontitis
Som det fremgår af ovenstående, eksisterer der ikke en genetisk test, der kan anvendes til at bedømme det enkelte individs risiko for stor parodontal sygdomsaktivitet. Dermed er det med den aktuelle viden naturligvis ikke i overensstemmelse med god klinisk praksis at tilbyde gennemførelse af gentest til patienterne. En sådan handling er ikke forenelig med den sundhedsvidenskabelige model for tandlægepraksis. Den er næppe heller forenelig med købmandsmodellen, da testen ikke leverer det, der loves (39). Med baggrund i den kompleksitet, der karakteriserer genernes mulige betydning for marginal parodontitis, kan man betvivle, at der nogensinde kommer en sådan test. Skulle en test for sygdomstilbøjelighed alligevel blive mulig, ville det dog rejse en række etiske spørgsmål, især fordi et positivt fund kunne medføre frygt hos de undersøgte patienter. Der ville også opstå betydelig risiko for sygeliggørelse af raske individer, hvilket er i konflikt med det nytteetiske princip, dvs. det princip, der indebærer, at udbyttet af en handling bør overstige de negative konsekvenser. Da det er vigtigt som tandlæge ikke at skabe unødig frygt (40), er der også af den grund et etisk problem, som ikke bare knytter sig til de undersøgte, men også til deres slægtninge (1,2).
Sygeliggørelse og frygt er negative effekter, og der kan spørges om, hvad der kunne være på positivsiden? Under alle omstændigheder må de kliniske fund danne grundlag for tilrettelæggelse af en behandling. Med den aktuelle viden betyder det, at en gentest næppe kan tilføre noget, der ændrer behandlingssituationen, hverken i hygiejnefasen, i den korrektive fase eller i vedligeholdelses- og kontrolfasen. Positivsiden er dermed vanskelig at få øje på.
Den fortsatte videnskabelige søgen efter genetiske faktorer, der kan spille en rolle for forståelsen af patogenesen ved aggressive former for marginal parodontitis, er væsentlig og kan tænkes med tiden at indebære øgede muligheder for effektiv behandling.
Gentest af subgingivale bakterier hos patienter med marginal parodontitis: etiske overvejelser
Det er muligt ved genetisk analyse af subgingival plak at bestemme forekomst og mængde af bakteriearter i plakken. Disse metoder er baseret udelukkende på analyse af bakteriernes DNA, og resultaterne påvirkes således ikke af, at kun ca. 50 % af plakkens bakterier er dyrkbare. Undersøgelsen kan være rettet mod opnåelse af et totalt billede af artssammensætningen eller mod identifikation af enkelte bakteriearter. I nogle få tilfælde har man mulighed for at teste for tilstedeværelsen af en enkelt bakterieklon inden for en art. Interessen for sådanne undersøgelser knytter sig til en hypotese om, at visse bakterier i særlig grad bidrager til udvikling af marginal parodontitis og måske i særlige tilfælde kan være hovedansvarlige for et aggressivt forløb af sygdommen. Disse bakteriers identitet og virkninger har været genstand for omfattende forskning (41,42) og skal ikke gennemgås detaljeret her.
Hypotetisk har det været fremført, at præcise oplysninger om plakkens sammensætning vil kunne føre til et optimalt valg af behandling, svarende til hvad der gælder ved behandling af eksogene infektioner med klassisk patogene mikroorganismer, hvor isolation, identifikation og antibiotisk resistenstest er standard (43,44). Berettigelsen af denne analogi er dog langtfra indlysende. For det første tilhører næsten alle kendte parodonto-patogene bakterier mundhulens fysiologiske normalflora, hvorfor antibiotisk behandling med den tilhørende uundgåelige forstyrrelse af mikrofloraens balance, så vidt muligt bør undgås. Antibiotisk behandling kan dog i visse tilfælde være indiceret (for detaljer, se (45)), men forsøges sjældent rettet mod enkelte, identificerede medlemmer af mikrofloraen. Tilmed kan et resistenstest-baseret valg af antibiotisk behandling, hvor denne måtte være indiceret, ikke med fordel foretages på grundlag af en genetisk analyse. For det andet er der ikke generelt grund til at antage, at parodontitis med en bestemt sammensætning af den lokale subgingivale flora bedst behandles efter et regime, der indrettes efter de mikrobiologiske fund.
Forskningsresultater fra de seneste år har dog identificeret en parodontitisform, hvor infektion med en bestemt bakterie synes at spille en dominerende rolle. Det drejer sig om aggressiv parodontitis induceret af en mikroflora indeholdende den såkaldte JP2-klon af bakterien Aggregatibacter actinomycetemcomitans (A.a.). Denne klon, som næsten udelukkende koloniserer børn og unge mennesker af afrikansk oprindelse, heriblandt afroamerikanere, er karakteriseret ved sin produktion af særligt store mængder af et leukotoksin, der dræber fagocyterende celler og efterlader vævet i forsvarsløs, men stærkt inflammeret tilstand. Bakteriens øgede produktion af toksin skyldes en mutation inden for det genområde, der regulerer toksinproduktionen. Dette udnyttes i en DNA-baseret påvisning af bakterien ved en såkaldt polymerase chain reaction, der kan udføres direkte på en prøve af hel plak (46). Der er for nylig udviklet apparatur til udførelse af denne test i områder uden laboratoriefaciliteter (47). Det er håbet, at testen kan spille en vigtig rolle i diagnostikken af denne sygdom og i evalueringen af den efterfølgende behandling. Der er endnu ikke udført systematiske behandlingsstudier af sygdommen, men det forekommer sandsynligt, at en optimal behandling bl.a. vil involvere administration af antibiotikum med virkning på JP2-klonen. Samtidig må det omvendt understreges, at genetisk analyse af plakprøver fra andre end individer med risiko for infektion med JP2-klonen af A.a. synes at savne faglig begrundelse.
Samlet set tilfører en genetisk test af subgingivale bakterier som hovedregel kun en beskeden information, hvis nytte er meget begrænset. Det etiske problem i denne sammenhæng er især knyttet til betalingen. Vil man udsætte patienten for en sådan udgift, når nyttevirkningen i bedste fald er dubiøs?
Konklusion
Der synes ikke at være tilstrækkelig saglig baggrund for at tilbyde genetisk test af patienter. Undtagelsesvis kan test af subgingival mikroflora for tilstedeværelse af JP2-klonen af A.a. være indiceret ved tilfælde af aggressiv parodontitis i særlige befolkningsgrupper af afrikansk oprindelse. De etiske problemer knytter sig til sygeliggørelse af raske personer, til etablering af frygt og til betaling for en ydelse, der savner fagligt grundlag.
English summary
Holmstrup P, Berglundh T, Reinholdt J.
Genetic tests in dentistry?
112-17
The possible significance of genetic variations for periodontal disease activity is briefly reviewed and it is concluded that there is no genetic test available for the clinical purpose of evaluating an individual''s periodontal disease susceptibility. Therefore, based on present knowledge, it is not considered good clinical practice to offer a genetic test to patients. Moreover, genetic test of the subgingival microflora adds only little information, the utility of which for the clinical handling of periodontitis patients is insignificant, with the possible exception of certain populations of African origin. The related ethical issues are particularly the possible creation of morbidity and fear among healthy individuals and the requirement to pay for a test without sufficient professional support.
Hovedbudskap | |
|---|---|
· |
Hvordan er gener knyttet til udvikling af marginal parodontitis? |
· |
Er der grundlag for genetisk test af parodontitispatienter? |
· |
Er der grundlag for genetisk test af den subgingivale mikroflora? |
· |
Den etiske udfordring er sygeliggørelse og betaling for nytteløs test. |
Litteratur
Kaare Skovmand. Genetisk test hos tandlægen. Politiken 1999; 116, 1. oktober: 1 - 2.
Politiken. Leder: Genetisk set. Politiken 1999; 116, 2. oktober: 3. sektion, p. 2.
Loos BG, van der Velden U, Laine ML. Susceptibility. In: Lindhe J, Lang NP, Karring T, eds. Clinical periodontology and implant dentistry. 5th ed. Oxford: Blackwell-Munksgaard, 2008.
Renz H, von Mutius E, Brandtzaeg P et al. Gene-environment interactions in chronic inflammatory disease. Nat Immunol. 2011; 12: 273 - 7.
O''Rahilly S. Human genetics illuminates the paths to metabolic disease. Nature. 2009; 462: 307 - 14.
Bell JT, Timpson NJ, Rayner NW et al. Genome-wide association scan allowing for epistasis in type 2 diabetes. Ann Hum Genet. 2011; 75: 10 - 9.
McCarthy MI. Genomics, type 2 diabetes, and obesity. N Engl J Med. 2010; 363: 2339 - 50.
Vognsen AS, Hansen CH. Epigenetik 2007. (Set 2012 oktober). Tilgængelig fra: URL: http://www.bric.ku.dk/publications/other_pubs/epigenetik.pdf/
Portela A, Esteller M. Epigenetic modifications and human disease. Nat Biotechnol. 2010; 28: 1057 - 68.
Heijmans BT, Tobi EW, Stein AD et al. Persistent epigenetic differences associated with prenatal exposure to famine in humans. Proc Natl Acad Sci. USA 2008; 105: 17046 - 9.
Eke PI, Dye BA, Wei L et al. Prevalence of periodontitis in adults in the United States: 2009 and 2010. J Dent Res. 2012; 91: 914 - 20.
Kornman KS, Crane A, Wang HY et al. The interleukin-1 genotype as a severity factor in adult periodontal disease. J Clin Periodontol. 1997; 24: 72 - 7.
Holmstrup P, Reinholdt J, Havemose-Poulsen A. Aspekter af marginal parodontitispatogenese. Tandlægebladet. 2011; 115: 662 - 9.
Hart TC, Shapira L, Van Dyke TE. Neutrophil defects as risk factors for periodontal diseases. J Periodontol. 1994; 65 (Supp 5): S521 - 9.
Michalowicz BS, Aeppli D, Virag JG et al. Periodontal findings in adult twins. J Periodontol. 1991; 62: 293 - 9.
Boughman JA, Astemborski JA, Suzuki JB. Phenotypic assessment of early onset periodontitis in sibships. J Clin Periodontol. 1992; 19: 233 - 9.
Marazita ML, Burmeister JA, Gunsolley JC et al. Evidence for autosomal dominant inheritance and race-specific heterogeneity in early-onset periodontitis. J Periodontol. 1994; 65: 623 - 30.
Kinane DF, Hart TC. Genes and gene polymorphisms associated with periodontal disease. Crit Rev Oral Biol Med. 2003; 14: 430 - 49.
Loos BG, John RP, Laine ML. Identification of genetic risk factors for periodontitis and possible mechanisms of action. J Clin Periodontol. 2005; .32 (Supp 6): S159 - 79.
Havemose-Poulsen A, Sørensen LK, Bendtzen K et al. Polymorphisms within the IL-1 gene cluster: effects on cytokine profiles in peripheral blood and whole blood cell cultures of patients with aggressive periodontitis, juvenile idiopathic arthritis, and rheumatoid arthritis. J Periodontol. 2007; 78: 475 - 92.
Nibali L, Griffiths GS, Donos N et al. Association between interleukin-6 promoter haplotypes and aggressive periodontitis. J Clin Periodontol. 2008; 35: 193 - 8.
Berglundh T, Donati M, Hahn-Zoric M et al. Association of the -1087 IL 10 gene polymorphism with severe chronic periodontitis in Swedish Caucasians. J Clin Periodontol. 2003; 30: 249 - 54.
Donati M, Liljenberg B, Padyukov L et al. Local expression of interleukin-10 and mCD14 in relation to the -1087IL-10 and the -159CD14 gene polymorphisms in chronic periodontitis. J Periodontol. 2008; 79: 517 - 24.
Larsson L, Rymo, L, Berglundh, T. Sp1 binds to the G allele of the-1087 polymorphism in the IL-10 promoter and promotes IL-10 mRNA transcription and protein production. Genes Immun. 2010; 11: 181 - 7.
Larsson L, Thorbert-Mros S, Rymo L et al. Interleukin-10 genotypes of the -1087 single nucleotide polymorphism influence sp1 expression in periodontitis lesions. J Periodontol. 2011; 82: 1376 - 82.
Geismar K, Enevold C, Sørensen LK et al. Involvement of interleukin-1 genotypes in the association of coronary heart disease with periodontitis. J Periodontol. 2008; 79: 2322 - 30.
Ioannidis JP. Genetic associations: false or true? Trends Mol Med. 2003; 9: 135 - 8.
Laine ML, Crielaard W, Loos BG. Genetic susceptibility to periodontitis. Periodontology. 2000 2012; 58: 37 - 68.
Sørensen LK, Havemose-Poulsen A, Bendtzen K et al. Aggressive periodontitis and chronic arthritis: blood mononuclear cell gene expression and plasma protein levels of cytokines and cytokine inhibitors. J Periodontol. 2009; 80: 282 - 9.
Sørensen LK, Havemose-Poulsen A, Sønder SU et al. Blood cell gene expression profiling in subjects with aggressive periodontitis and chronic arthritis. J Periodontol. 2008; 79: 477 - 85.
Laine ML, Loos BG, Crielaard W. Gene polymorphisms in chronic periodontitis. Int J Dent. 2010; 2010: 324719.
Grigoriadou ME, Koutayas SO, Madianos PN et al. Interleukin-1 as a genetic marker for periodontitis: review of the literature. Quintessence Int. 2010; 41: 517 - 25.
Hindorff LA, Sethupathy P, Junkins HA et al. Potential etiologic and functional implications of genome-wide association loci for human diseases and traits. Proc Natl Acad Sci. USA 2009; 106: 9362 - 7.
Estrada K, Styrkarsdottir U, Evangelou E et al. Genome-wide meta-analysis identifies 56 bone mineral density loci and reveals 14 loci associated with risk of fracture. Nat Genet. 2012; 44: 491 - 501.
Schaefer AS, Richter GM, Nothnagel M et al. A genome-wide association study identifies GLT6D1 as a susceptibility locus for periodontitis. Hum Mol Genet. 2010; 19: 553 - 62.
Hart TC, Atkinson JC. Mendelian forms of periodontitis. Periodontol. 2000. 2007; 45: 95 - 112.
Toomes C, James J, Wood AJ et al. Loss-of-function mutations in the cathepsin C gene result in periodontal disease and palmoplantar keratosis. Nat Genet. 1999; 23: 421 - 4.
Hart TC, Hart PS, Bowden DW et al. Mutations of the cathepsin C gene are responsible for Papillon-Lefèvre syndrome. J Med Genet. 1999; 36: 881 - 7.
Holmstrup P, Rossel PJH. Tandlægeetik i år 2000 - og fremover. I: Holmstrup P, ed. Odontologi 2000. København: Munksgaard, 2000; 23 - 38.
Holmstrup P. Er der etiske problemer i tandlægens hverdag? Tandlægebladet. 1997; 101: 400 - 10.
Colombo AP, Boches SK, Cotton SL et al. Comparisons of subgingival microbial profiles of refractory periodontitis, severe periodontitis, and periodontal health using the human oral microbe identification microarray. J Periodontol. 2009; 80: 1421 - 32.
Rylev M, Kilian M. Prevalence and distribution of principal periodontal pathogens worldwide. J Clin Periodontol. 2008; 35 (Supp 8): S346 - 61.
van Winkelhoff AJ, Winkel EG. Systemic antibiotic therapy in severe periodontitis. Curr Opin Periodontol. 1997; 4: 35 - 40.
Van Winkelhoff AJ, Boutaga K. Transmission of periodontal bacteria and models of infection. J Clin Periodontol. 2005; 32 (Supp 6): S16 - 27.
Havemose-Poulsen A. Behandling af aggressiv marginal parodontitis. Tandlægebladet. 2011; 115: 734 - 41.
Poulsen K, Ennibi OK, Haubek D. Improved PCR for detection of the highly leukotoxic JP2 clone of Actinobacillus actinomycetemcomitans in subgingival plaque samples. J Clin Microbiol. 2003; 41: 4829 - 32.
Seki M, Poulsen K, Haubek D et al. Novel loop-mediated isothermal amplification method for detection of the JP2 clone of Aggregatibacter actinomycetemcomitans in subgingival plaque. J Clin Microbiol. 2008; 46: 1113 - 5.
professor, dr.odont., ph.d., odont.dr. (h.c.). Afdeling for Parodontologi, Odontologisk Institut, Det Sundhedsvidenskabelige Fakultet, Københavns Universitet
professor, odont.dr. Avdeling för Parodontologi, Institutionen för Odontologi, Sahlgrenska Akademin, Göteborg Universitet
lektor, ph.d. Afdeling for Oral Biologi, Odontologisk Institut, Health, Aarhus Universitet
Adresse: Palle Holmstrup, e-mail: pah@sund.ku.dk
Artikkelen har gjennomgått ekstern faglig vurdering.
Holmstrup P, Berglundh T, Reinholdt J. Genetisk test hos tandlægen? Nor Tannlegeforen Tid. 2013; 123: 112-17