Melketenner som kilde til biomarkører i epidemiologisk forskning
Melketenner kan gi viktig informasjon om kroppens opptak av sporelementer på fosterstadiet og tidlig i barndommen - perioden for tanndannelsen og den mest sårbare perioden i livet. Sporstoffer fra barnets omgivelser og ernæring bygges inn i tannvevet etter hvert som tennene dannes og senere ved dannelsen av sekundærdentin. Fordi tannvevet dannes lagvis etter et kjent mønster og dessuten er svært stabilt, kan tenner fungere som en slags ferdsskriver for ulike eksponeringer i tanndanningsperioden. I denne artikkelen presenteres hvordan melketenner har vært brukt og brukes i forskningssammenheng med spesiell vekt på epidemiologisk forskning.
Melketenner kan gi viktig informasjon om eksponering overfor sporelementer, både essensielle og rent toksiske, på fosterstadiet og i tidlig barndom. Denne perioden av livet regnes for å være spesielt sensitiv med hensyn til eksponering for miljøgifter, fordi organene er umodne, og barrierene mot det ytre miljøet ikke er ferdigutviklet (1). Fordi kroppen er i rask vekst, har barn generelt høyere metabolisme enn voksne og utsettes potensielt for større mengder forurensning per kilo kroppsvekt som en følge av høyere oksygenforbruk og større inntak av mat og drikke per kilo kroppsvekt (2). Småbarn putter også gjerne ting i munnen som inneholder helsefarlige stoffer. En spesiell oppmerksomhet må derfor rettes mot barns ytre miljø.
Nye levesett og kostholdsvaner kan også virke inn på helsen. For lavt innhold av essensielle sporelementer i kostholdet vil kunne gi helseutfall på kortere eller lengre sikt (3). Ulike kontrollrutiner kreves for å overvåke miljøeksponering og kostholdsvaner. Enkelte vev og væsker i kroppen kan brukes til å måle kroppens opptak av elementer og forbindelser fra miljøet, såkalte biomarkører for eksponering (4). Melketenner har vært brukt som kilde til biomarkører i en rekke studier og kan gi viktig informasjon om barnets miljø på fosterstadiet og i tidlig barndom (5 - 7). Sporstoffer fra miljøeksponering og kosthold bygges inn i tannvevet etter hvert som tennene dannes. Fordi tannvevet dannes lagvis etter et kjent mønster og dessuten er svært stabilt, kan tenner fungere som en slags ferdsskriver for ulike eksponeringer i tanndanningsperioden (8,9,10). Tannvev kan også vise morfologiske forandringer og mineraliseringsdefekter som resultat av eksponering overfor miljøgifter, sykdom eller ernæringssvikt i løpet av tanndannelsen (11,12,13).
Melketenner har vært brukt i en rekke epidemiologiske undersøkelser rundt om i verden for å avdekke områder med miljøforurensning (14 - 17), for å undersøke hviken påvirkning eksponeringer for toksiske sporelementer har på barns utvikling og helse (18 - 19) og for å kartlegge ernæringstilstanden hos grupper av barn (7,20). I Norge har det vært utført to større undersøkelser på 1970- og 1990-tallet ved Universitetet i Bergen (15). I 1992 ble en tannbank for felte melketenner etablert, bestående av innsamlede humane melketenner fra ulike geografiske områder i inn- og utland. Helsedirektoratet ga støtte til opprettelsen av tannbanken i brevs form (ref. 91/04675 2 PAC/). En betydelig del av tannmaterialet ble samlet inn av den norske tannlegestand, og en rekke artikler med forskningsresultater fra tannanalyser ble publiserte (15,21,22). Denne tannbanken er nå registrert i Forskningsbiobanken, Osteologiske samlinger, Universitetsmuseet i Bergen, som Professor Fosses tannsamling (nr. 201 - 2006 - 153959.xml) (23). En ny biobank for humane melketenner er nå under oppbygning ved Universitetet i Bergen i samarbeid med Folkehelseinstituttets nasjonale prosjekt «Den norske mor og barn-undersøkelsen» (24).
I denne artikkelen presenteres hvordan melketenner har vært brukt og brukes i forskningssammenheng for å øke kunnskapen om barns opptak av toksiske og essensielle elementer, tatt opp i kroppen fra det ytre miljø og fra kosthold. Videre drøftes hvordan denne kunnskapen kan brukes til å forebygge helseskader.
Melketennenes utvikling
Melketannsettet starter sin utvikling allerede i løpet av den andre måned av fosterstadiet (25). I løpet av tredje til fjerde måned starter mineraliseringen av tannanleggene (26). Ved ettårsalder er alle melketannskronene ferdig mineralisert, og ved tre til tre og et halvt års alder er også røttene ferdigdannet (figur 1). Tennene vokser lagvis etter et kjent mønster og danner vekstlinjer i vevet som kan sammenlignes med årringene i en trestamme (9,10). Både i emaljen og det underliggende dentinet finnes en karakteristisk vekstlinje, neonatallinje, som representerer endret metabolisme ved fødselen. Neonatallinjen i emalje er spesielt tydelig histologisk som en følge av endret konfigurasjon i emaljeprismene i denne perioden (27). Lokalisasjon av neonatallinjen gjør det mulig å skille tannvev som er dannet pre- og postnatalt (figur 2).
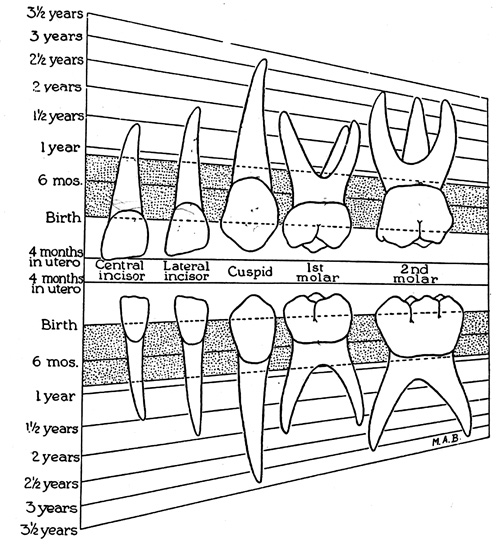
Figur 1. Illustrasjonen viser hvor stor del av melketennene som er mineralisert ved de angitte tidspunkt i kolonnen til venstre. [W. Krogh-Poulsen. Tændernes morfologi. København: Munksgaard, 1967]. Figuren er trykket med tillatelse fra Munksgaard forlag.
Det skjer en langsom dannelse av dentin (sekundærdentin) innerst mot pulpa gjennom hele tannens funksjonstid. Dette vevet representerer dermed en senere periode i barndommen frem mot tannfellingen (25). Melketennene felles i løpet av barneårene og kan dermed gjøres tilgjengelige for forskningeprosjekter uten invasive ingrep. Tannvev er det mest bestadige vevet i kroppen, og lagringstiden er nærmest ubegrenset.
Biomarkører
Begrepet biomarkør kan defineres som «målbare og kvantifiserbare biologiske parametere som fungerer som indekser for helse- og fysiologirelaterte vurderinger, for eksempel sykdomsrisiko, miljøeksponering og dens effekter, sykdomsdiagnose, epidemiologiske studier, etc» (28). Man skiller gjerne mellom tre hovedtyper: biomarkører for eksponering, effekt og følsomhet (29). Biomarkører for eksponering gir oss informasjon om opptaket av sporelementer/forbindelser i kroppen mens de to andre typene biomarkørere gir informasjon om henholdsvis effekten og individets følsomhet overfor disse. Melketenner brukes typisk som kilde til biomarkører for eksponering, idet man måler tilstedeværelsen eller konsentrasjoner av sporelementer i vevet som en markør for individets eksponeringesgrad. Av definisjonen over, vil de målte konsentrasjonene av sporelementer eller kjemikalier i seg selv være biomarkørene. I litteraturen benevnes gjerne det analyserte vevet som biomarkør, underforstått dets konsentrasjoner av de målte elementene. Eksempler på vev og kroppsvæsker som benyttes som kilde til biomarkører for eksponering er blod, urin, saliva, hår, negler, bein og tenner. Alle disse vevene har sine fordeler og begrensninger når det gjelder egnetheten til å kartlegge kroppens interne miljø (30). For eksempel viser blykonsentrasjonen i blod, med en halveringstid på ca. 40 dager, den pågående eksponeringen overfor elementet, mens konsentrasjonen i beinvev, med en halveringstid på 10 - 30 år, viser den kumulative eksponeringen (31).
Tenner som kilde til biomarkører for eksponering
Tannvev gjennomgår ikke remodellering etter at tannen er ferdigdannet, slik tilfellet er for beinvev (32). Elementer som er bygget inn i vevet under tanndannelsen, blir stort sett værende der og representerer dermed opptaket av disse elementene i tanndannelsesperioden. Fordi tennene vokser lagvis etter et kjent mønster og avsetter vekstlinjer i vevet (9), er det mulig å måle innholdstoffer på tvers av vekstlinjene og dermed registrere eksponeringer over et lengre tidsrom. I melketennene gjør neonatallinjen det mulig å skille mellom pre- og postnatalt tannvev som så kan måles for kjemisk innhold ved hjelp av avanserte analysemetoder (33).
Tennenes hardvev har vist seg egnet som kilde til biomarkører for en rekke sporelementer, både essensielle og toksiske. De bensøkende sporelementene, som sink, bly og strontium, tar kalsium sin plass i hydroxyapatitten og danner stabil binding i det mineraliserte tannvevet (34). Tennenes høye mineralinnhold og lave grad av elementutveksling gjør dem spesielt egnet som kilde til biomarkører for de bensøkende sporelementene. Forhold som gjør melketenner egnet som kilde til biomarkører er listet opp i boks 1.
Boks 1. Melketenners egnethet som kilde for biomarkører:
Det er det eneste stabile vevet, dannet på fosterstadiet og i tidlig barndom, som er tilgjengelig for analyse i stor skala på et senere tidspunkt.
De dannes lagvis etter et kjent mønster med en markert vekstlinje omkring fødselen.
De felles naturlig og er tilgjengelige uten fysiske inngrep.
Det er relativt lave kostnader forbundet med innsamling og oppbevaring.
De har tilnærmet ubegrenset lagringstid i tørr tilstand ved normal temperatur.
Metoder for analyser av sporelement i melketenner
En rekke forskjellige metoder brukes ved kjemisk analyse av melketenner, avhengig av hvilke sporelementer eller kjemiske forbindelser man ønsker å undersøke. Tidligere var det mest vanlig å løse hele tannen eller pulveriserte deler av tannvevet i syre før kjemisk analyse (15,35). Da registrerer man det kumulative innholdet av de analyserte sporelementene i tannen. Nå kan man, ved hjelp av mer avanserte teknikker, ta serier av prøver på slipesnitt av tannen på tvers av vekstlinjene (33,36). Etter registrering av neonatallinjen (figur 2), kan melketannen analyseres for sporelementinnhold i tannvev dannet før og etter fødselen, for å kartlegge variasjoner i elementinnholdet (6,37). Denne metoden er også mindre destruktiv idet bare en mindre del av tannen brukes i analysen. Resten kan bevares til eventuelle senere studier.
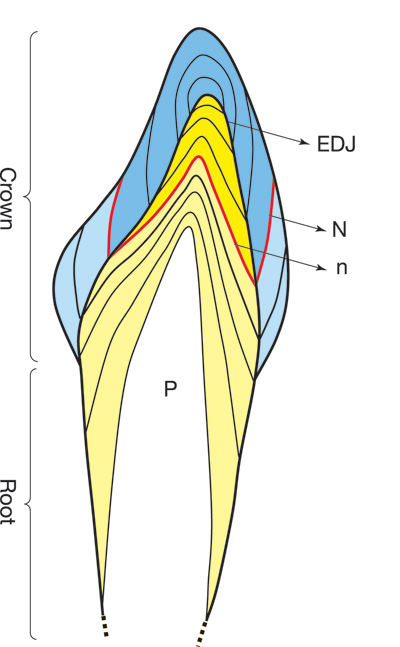
Figur 2. Illustrasjon av longitudinelt snitt av en melketann i utvikling. Vekstlinjer er markert i emalje (blå) og krone- og rotdentin (gul). Merk skillet mellom pre- og postnatal emalje og dentin markert ved neonatallinjen (N = neonatallinje i emalje, n = i dentin). Prenatalt dannet emalje og dentin er mørkest farget på tegningen. P = pulpakammeret, EDJ = emalje-dentin grensen.
Tannvevet er ikke homogent. Sporelementinnholdet varierer mellom emalje, dentin og sekundærdentin og også innen de forskjellige vevstypene. Man finner også variasjoner i sporelementinnhold mellom de forskjellige tanntyper innen samme melketannsett (37,38). Dette kan blant annet forklares med at tanndannelsesperioden for de forskjellige tanntypene ikke er helt overlappende (figur 1). Hvilke tanntyper og tannvev som blir brukt i melketannsanalyser varierer. I noen studier er bare én tanntype benyttet, i andre er flere typer brukt (35). Noen har analysert emalje, andre dentin, rotdentin, rotsement eller hele tannen. Dette gjør sammenligning mellom studier vanskelig. I en studie der 1200 norske melketenner ble analysert, fant man signifikant høyere konsentrasjoner av bly, kvikksølv og sink i tenner med karies sammenlignet med tenner uten karies, og konsentrasjonen av de samme elementene varierte med tanntype (38).
Selv om de kjemiske analysemetodene er i stadig utvikling og nye kommer til, er det fremdeles begrensninger forbundet med disse. Det er fortsatt en mangel på tilfredsstillende referansematerialer for mineralisert vev til bruk i kjemiske analyser av en rekke sporelementer (37,39). Utvikling av solide referansematerialer er dermed en forutsetning for å oppnå høyere grad av nøyaktighet ved analyser av disse elementene i tannvev.
Bly og andre sporelementer i melketenner
Bly er det sporelementet som har vært mest studert i melketannsvev. En studie utført i USA i 1962 sammenlignet blykonsentrasjonen i melketenner fra en gruppe barn som var døde på grunn av blyforgiftning, en gruppe barn som overlevde etter blyforgiftning, samt en kontrollgruppe med barn uten kjent eksponering (40). Blykonsentrasjonen i tenner fra de blyforgiftede barna var åtte til ti ganger høyere enn hos kontrollgruppen. I studier fra 1970-tallet og frem til i dag er konsentrasjonen av bly i melketenner blitt brukt for å kartlegge blyeksponering hos barn, for eksempel i områder nær forurensende industri og områder med tett biltrafikk (14,41,42). Resultater fra to landsomfattende tverrsnittsundersøkelser i Norge, utført på 1970- og 1990-tallet, viste at blykonsentrasjonen i melketenner var halvert i løpet av de 20 årene mellom de to undersøkelsene (15). Over 2700 melketenner fra 58 forskjellige kommuner i landet ble analysert. Resultatene korresponderer med nedgangen i blyforurensning i Norge i dette tidsrommet.
Melketenner er også blitt brukt for å kartlegge virkningen av bly på barnehelsen, med særlig vekt på nevrofysiologiske forhold (43,44). Det er blitt påvist signifikante korrelasjoner mellom forhøyede blykonsentrasjoner i melketenner og lave skår på en rekke nevropsykologiske tester og IQ-tester (18,19).
En rekke andre sporelementer er også blitt analysert i melketannsvev, både toksiske og essensielle (5,37,45 - 48). Brown et al. (20) analyserte sporelementer i melketenner fra en gruppe ugandiske og en gruppe britiske barn. Gruppen av ugandiske barn hadde signifikant lavere verdier av sink, samt signifikant høyere verdier av blant annet strontium og barium, mens aluminium, kobber, bly og uran ikke viste signifikante forskjeller mellom de to gruppene. Det ble konkludert at det fysiske miljø og ernæring påvirker elementinnholdet i tannvev.
Melketenner har vært brukt som biomarkører for eksponering overfor miljøgifter i mer enn 50 år. Metoder for blyanalyser av mineralisert tannvev er vel dokumentert, og et terskelnivå for påvisbar skadelig eksponering er blitt foreslått (18). For andre sporelementer er man ikke kommet så langt, men det arbeides blant annet med metodeutvikling for bruk av melketenner som biomarkør for manganeksponering (47). Mangan har nevrotoksisk potensial og er kommet i søkelyset fordi det brukes som antibankemiddel i bensin, som erstatning for bly. Dette vil føre til en økning av mangan i miljøet, med ukjente konsekvenser.
Radioaktive isotoper
Melketenner er blitt brukt i kartlegging av eksponering overfor radioaktive isotoper etter utslipp fra kjernekraftverk og kjernefysiske prøvesprengninger (49 - 51). En undersøkelse publisert i 2003 viste at konsentrasjonen av radioaktivt strontium (Sr-90) i over 2 000 undersøkte melketenner fra 5 stater i USA, økte uventet hos barn født sent på 1990-tallet i forhold til barn født på 1980-tallet. Barn som bodde nær kjernekraftverk, viste de høyeste konsentrasjonene (52). I en retrospektiv case-control-studie, publisert i USA i 2010, ble konsentrasjonen av Sr-90 i 97 melketenner fra personer født mellom 1959 og 1961 og som senere ble diagnostisert med kreft, sammenlignet med tilsvarende konsentrasjoner i 194 melketenner fra en matchende kontrollgruppe av friske personer (51). Personer i testgruppen som var døde som følge av kreft, hadde signifikant høyere gjennomsnittlig nivå av Sr-90 i tennene enn kontrollgruppen. I England ble det funnet høyere konsentrasjoner av plutonium i melketenner fra barn bosatt nær Sellafield i forhold til barn bosatt i lengre avstand fra dette gjennvinningsanlegget for radioaktive materialer (49). I en studie fra Sveits publisert i 2006 fant man derimot ingen økning i Sr-90 i melketenner fra barn bosatt nær kjernekraftverk på 1990-tallet (53). Slik kan melketenner brukes til å overvåke miljøet for skadelige stoffer og gi viktig informasjon til myndighetene om eventuelle behov for forebyggende tiltak.
Utviklingsdefekter i tannvev
Utviklingsdefekter kan observeres i melketenner både som hypoplasier og som hypomineraliserte områder i vevet (54,55). Årsaken til disse forandringene er ikke fullstendig klarlagt, men underernæring, sykdomstilstander, prematur fødsel og eksponering overfor miljøgifter er foreslått (11,13,56). Utviklingsdefekter på grunn av forhøyet eksponering overfor fluor er veldokumentert (57), men også organiske miljøgifter kan påvirke tanndannelsen. I en studie utført i Slovakia i 2007 ble effekten av langvarig eksponering for polyklorerte bifenyler (PCB) på dental utvikling undersøkt (11). Permanente tenner og melketenner fra 432 barn på 8 og 9 år, bosatt i et kjent PCB-kontaminert område, ble undersøkt for morfologiske avvik. Det ble funnet en dose-respons-sammenheng mellom utviklingsdefekter i emalje i de permanente tennene og grad av PCB-eksponering. Data fra melketennene viste samme tendens, men funnene var ikke statistisk signifikante. Metoder for kjemisk analyse av organiske miljøgifter i mineralisert tannvev er noe man per i dag ikke finner tilgjengelig.
Melketenner i prospektiv epidemiologisk forskning
Studier der melketenner inngår som kilde til biomarkører, har ofte vært utformet som tverrsnitts-undersøkelser (15), men mange longitudinelle studier og studier med retrospektivt design er også blitt publisert (58,59,51). Et stort antall longitudinelle prospektive kohort-studier av mor og barns helse pågår nå rundt om i Europa (60 - 62). Den norske mor og barn-undersøkelsen (MoBa) (60) er en stor og omfattende slik kohort-studie som følger mer enn 100 000 barn fra fosterstadiet og gjennom oppveksten (63). Det overordnede mål er å øke kunnskapen om årsaker til sykdom og helse samt øke mulighetene for bedre forebygging og behandling. Undersøkelsen bygger på besvarte spørreskjema under graviditeten og i barnets oppvekst, samt biologisk materiale fra mor, far og barn (64). En biobank for melketenner fra barna i undersøkelsen er også etablert (24). Det er planlagt at forskere med aktuelle problemstillinger kan søke om å få hente utvalg av tenner fra populasjoner som skal studeres, samt tenner fra matchende kontrollgrupper, sammen med aktuelle svar fra spørreskjema og eventuelle andre biologiske prøver som er tilgjengelige. Resultater fra melketannsanalyser vil kunne være med på å avdekke kausale årsaker til ulike avvik eller sykdomsutvikling hos barna. Denne kunnskapen kan så brukes i planlegging av forebyggende tiltak (figur 3). I en tilsvarende kohort-studie som pågår i England, the Avon Longitudinal Study of Parent and Child (ALSPAC) (61), er det også samlet inn melketenner.
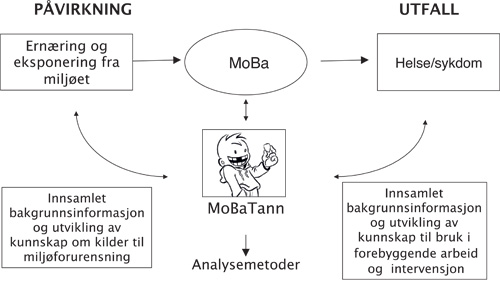
Figur 3. Skjematisk fremstilling av hvordan man planlegger at biobanken for felte melketenner innen Den norske mor og barn-undersøkelsen (MoBaTann) skal gi ny kunnskap om sammenhenger mellom eksponering og helsetilstand, og hvordan dette kan benyttes i forebyggende arbeid.
Til tross for at melketenner har vært benyttet i epidemiologisk forskning i mer enn 50 år, har mulighetene til å påvise årsakssammenhenger mellom eksponering og sykdom vært begrenset, blant annet på grunn av studiedesign. Spesielt gjelder dette tverrsnittsundersøkelsene, ettersom de alene ikke vil kunne fastslå kausalitet for sykdom og derfor har lavere verdi i forhold til prospektive studier når det gjelder å finne årsakssammenhenger. I hvilken grad melketenner vil komme til nytte som kilde til biomarkører i de store prospektive studiene, MoBa og ALSPAC, vil være avhengig av at tilstrekkelig mange tenner samles inn, og at de eksisterende metodene for kjemiske analyser videreutvikles. Potensialet er i alle fall stort på grunn av tannvevets unike struktur som gjør det mulig å ta prøver som representerer eksponeringer over et lengre tidsintervall i barnets utvikling, både pre- og postnatalt. Videre er tannvev så stabilt at det har en nærmest ubegrenset holdbarhet og vil dermed være tilgjengelig for analyser langt inn i fremtiden når nye problemstillinger blir utformet, og forbedrede eller nye analysemetoder blir tilgjengelige.
English summary
Human primary teeth as a source of biomarkers of exposure within epidemiological research
Human primary teeth can give important information about trace element exposure prenatally and during early childhood - the period of tooth formation and the most vulnerable period in life. Trace elements, from the environment and from nutrition, toxic as well as essential, are built into the tooth tissues during the period of tooth formation and later during secondary dentine formation. Since tooth tissues develop incrementally, according to a known pattern, and are very stable, teeth can be used as source of biomarkers revealing different exposures during the period of tooth formation. In this paper the use of primary teeth as source for biomarkers of exposure is presented with a special focus on the use within epidemiology.
Meyer Tvinnereim H, Rørvik Langseth M, S. Klock K. Melketenner som kilde til biomarkører i epidemiologisk forskning. Nor Tannlegeforen Tid. 2014;124:552-556. doi:10.56373/2014-7-9
Hovedbudskap | |
|---|---|
· |
Sporstoffer fra miljø og ernæring bygges inn i tannvevet etter hvert som tennene dannes. |
· |
Fordi tannvevet dannes lagvis etter et kjent mønster og dessuten er svært stabilt, kan tenner fungere som en slags ferdsskriver for ulike eksponeringer i tanndanningsperioden. |
· |
Melketenner har vært brukt i en rekke epidemiologiske undersøkelser rundt om i verden for å avdekke områder med miljøforurensning, undersøke hviken påvirkning eksponeringer for toksiske sporelementer har på barns utvikling og helse og for å kartlegge ernæringstilstanden hos grupper av barn. |
· |
En tannbank for felte melketenner ble etablert i 1992. En større del av tannmaterialet ble samlet inn av norske tannleger? |
· |
En ny biobank for norske melketenner er under oppbygning ved UiB i samarbeid med Folkehelseinsituttet (Den norske mor og barn-undersøkelsen). Innledning |
Fullstendig referanseliste
Wigle DT, Arbucle TE, Turner MC, Berube A, Yang Q, Liu S, Krewski D. Epidemiologic evidence of relationships between reproductive and child health outcomes and environmental chemical contaminants. J Toxicol Environ Health, Part B. 2008; 11(5-6): 373-517.
Bearer CF. How are children different from adults? Environ Health Perspect. 1995; 103 (Suppl 6): 7-12.
Barker DJ, Osmond C, Kajantie E, Eriksson JG. Growth and chronic disease: findings in the Helsinki Birth Cohort. Annals Human Biol. 2009; 36(5): 445-58.
Jones R. The importance of biological samples in longitudinal birth cohort studies. Paediatr Perinat Epidemiol. 2009; 23 (Suppl 1): 93-102.
dela Cruz GG, Rozier RG, Bawden JW. Fluoride concentration in dentin of exfoliated primary teeth as a biomarker for cumulative fluoride exposure. Caries Res. 2008; 42(6): 419-28.
Ericson JE. Enamel lead biomarker for prenatal exposure assessment. Environ Res. 2001; 87(3): 136-40.
Dolphin AE, Goodman AH. Maternal diets, nutritional status, and zinc in contemporary Mexican infants' teeth: Implications for reconstructing paleodiets. Am J Phys Anthrop. 2009; 140(3): 399-409.
Sharon IM. The significance of teeth in pollution detection. Perspec Biol Med. 1988; 32: 124-131.
Dean MC, Scandrett AE. The relation between long-period incremental markings in dentine and daily cross-striations in enamel in human teeth. ArchOral Biol. 1996; 41(3): 233-41.
Jan J, Sovcikova E, Kocan A, Wsolova L, Trnovec T. Developmental dental defects in children exposed to PCBs in eastern Slovakia. Chemosphere. 2007; 67(9): 350-54.
Ewers U, Turfeld M, Freier I, Hofstetter I, Stemmann G, Brockhaus A. Levels of lead and cadmium in milk teeth of children from Stolberg and some other cities of West-Germany: chronological trend 1968-1993. Zbl Hyg. 1996; 198: 318-330.
Tvinnereim HM, Eide R, Riise T, Wesenberg GR, Fosse G, Steinnes E. Lead in primary teeth from Norway: changes in lead levels from the 1970s to the 1990s. Sci Total Environ. 1997; 207(2-3): 165-77.
Hernandez-Guerrero JC, Jimenez-Farfan MD, Belmont R, Ledesma-Montes C, Baez A. Lead levels in primary teeth of children living in Mexico City. Int J Paed Dent. 2004; 14(3): 175-81.
Tvinnereim HM, Fantaye W, Isrenn R, Bjorvatn K, Melaku Z, Teklehaimanot R. Lead levels in primary teeth in children from urban and rural areas in Ethiopia. Ethiop Med J. 2011; 49(1): 61-6.
Pocock SJ, Smith M, Baghurst P. Environmental lead and children's intelligence: a systematic review of the epidemiological evidence. BMJ. 1994; 309: 1189-97.
Marcus DK, Fulton JJ, Clarke EJ. Lead and conduct problems: a meta-analysis. Journal of clinical child and adolescent psychology: the official journal for the Society of Clinical Child and Adolescent Psychology, American Psychological Association, Division 53. 2010; 39(2): 234-41.
Brown CJ, Chenery SR, Smith B, Mason C, Tomkins A, Roberts G J, Sserunjogi L. Tiberindwa, J. V. Environmental influences on the trace element content of teeth - implications for disease and nutritional status. Arch Oral Biol. 2004; 49(9): 705-17.
Fosse G, Eide R, Wesenberg GB. Tannbank - databank I miljøovervåkning. Nor Tannlegeforen Tid. 1992; 102(13): 18-22.
Eide R, Wesenberg GBR, Fosse G. Mercury in primary teeth in preindustrial Norway. Scan J Dent Res. 1993; 101: 1-4.
Universitetsmuseet i Bergen: http://bergenmuseum.uib.no/fagsider/osteologi/ost_barnetann.htm (avlest 17.10.13).
Tvinnereim HM, Lygre GB, Schreuder P, Haug K, Klock KS. A biobank of primary teeth within the Norwegian Mother and Child Cohort Study (MoBa): a resource for the future. Pediatr Perinat Epidemiol. 2012; 26, 264-71.
Berkovitz B, Holland G, Moxham M. Oral Anatomy, Histology and Embyology. 4th ed. London: Mosby; 2009.
Schour I, Massler M. The development of human dentition. J Am Dent Assoc. 1941; 28: 1153-1160.
Sabel N, Johansson C, Kuhnisch J, Robertson A, Steiniger F, Noren JG, Klingberg G, Nietzsche S. Neonatal lines in the enamel of primary teeth--a morphological and scanning electron microscopic investigation. Arch Oral Biol. 2008; 53(10): 954-63.
National Center for Biotechnology Information. http://www.ncbi.nlm.nih.gov/mesh/68015415 (avlest 29.10.10).
Grandjean P. Biomarkers in epidemiology. Clin Chem. 1995; 41(12B) 1800-1803.
Jones R, Golding J. Choosing the types of biological sample to collect in longitudinal birth cohort studies. Paediatr Perinat Epidemiol. 2009; 23 (Suppl 1): 103-13.
Barbosa FJr, Tanus-Santos JE, Gerlach RF, Parsons PJ. A critical review of biomarkers used for monitoring human exposure to lead: advantages, limitations, and future needs. Environ Health Perspec. 2005; 113(12): 1669-74.
Steenhout A. Kinetics of lead storage in teeth and bones: An epidemiological approach. Arch Environ Health. 1982; 37: 224-230.
Birch W, Dean C. Rates of enamel formation in human deciduous teeth. Front Oral Biol. 2009; 13: 116-20.
Arora M, Chan SW, Kennedy BJ, Sharma A, Crisante D, Walker DM. Spatial distribution of lead in human primary teeth as a biomarker of pre- and neonatal lead exposure. Sci Total Environ. 2006; 371(1-3): 55-62.
Blumenthal NC. The in vitro uptake of trace elements by hydroxyapatite. In: Trace metals and fluoride in bones and teeth. Editors: Priest ND, Van De Vyver FL. Boca Raton: CRC Press, 1990; pp. 307-314.
Fergusson JE, Purchase NG. The analysis and levels of lead in human teeth: a review. Environ Pollut. 1987; 46: 11-44.
Kang D, Amarasiriwardena D, Goodman AH. Application of laser ablation-inductively coupled plasma-mass spectrometry (LA-ICP-MS) to investigate trace metal spatial distributions in human tooth enamel and dentine growth layers and pulp. Anal Bioanal Chem. 2004; 378(6): 1608-15.
Dolphin AE, Goodman AH, Amarasiriwardena DD. Variation in elemental intensities among teeth and between pre- and postnatal regions of enamel. Am J Phys Anthrop. 2005; 128(4): 878-88.
Tvinnereim HM, Eide R, Riise T. Heavy metals in human primary teeth: some factors influencing the metal concentrations. Sci Total Environ. 2000; 255(1-3): 21-7.
Bellotto VR, Miekeley N. Improvements in calibration procedures for the quantitative determination of trace elements in carbonate material (mussel shells) by laser ablation ICP-MS. Fresenius J Anal Chem. 2000; 367(7): 635-40.
Altshuller LF, Halak DB, Landing BH, Kehoe RA. Deciduous teeth as an index of body burden of lead. J Pediatr. 1962; 60: 224-229.
Lyngbye T, Hansen ON, Grandjean P. Predictors of Tooth-Lead Level with Special Reference to Traffic - A Study of Lead-Exposure in Children. Int Arch Occup Environ Health. 1990; 62: 417-422.
Hegde S, Sridhar M, Bolar DR, Bhaskar SA, Sanghavi MB. Relating tooth- and blood-lead levels in children residing near a zinc-lead smelter in India. Int J Paediatr Dent. 2010; 20(3): 186-92.
Hansen ON, Trillingsgaard A, Beese I, Lyngbye T, Grandjean P. A neuropsychological study of children with elevated dentine lead level: Assessment of the effect of lead in different socio-economique groups. Neurotoxicol Teratol. 1989; 11: 205-213.
McMichael AJ, Baghurst PA, Vimpani GV, Wigg NR, Robertson EF, Tong SL. Tooth lead levels and IQ in school-age children: The Port Pirie cohort study. Am J Epidemiol. 1994; 140: 489-499.
Tvinnereim HM, Eide R, Fosse G, Wesenberg GR, Szøke J, Banoczy J. Trace elements in primary teeth from six areas in Hungary. Int J Environ Stud. 1996; 50: 267-275.
Tvinnereim HM, Eide R, Riise T, Fosse G, Wesenberg GR. Zinc in primary teeth from children in Norway. Sci Total Environ. 1999; 226(2-3): 201-12.
Ericson JE, Rinderknecht A, Gonzalez EJ, Crinella FM, Kleinman MT. Measurements of manganese with respect to calcium in histological enamel cross sections: toward a new manganese biomarker. Environ Res. 2001; 86(1): 46-50.
Fischer A, Kwapulinski J, Wiechula D, Fischer T, Loska M. The occurrence of copper in deciduous teeth of girls and boys living in Upper Silesian Industry Region (Southern Poland). Sci Total Environ. 2008; 389(2-3): 315-9.
O'Donnell RG, Mitchell PI, Priest ND, Strange L, Fox A, Henshaw DL, Long SC. Variations in the concentration of plutonium, strontium-90 and total alpha-emitters in human teeth collected within the British Isles. Sci Total Environ. 1997; 201(3): 235-43.
Gould JM, Sternglass EJ, Sherman JD, Brown J, McDonnell W, Mangano JJ. Strontium-90 in deciduous teeth as a factor in early childhood cancer. Int J Health Serv. 2000; 30(3): 515-39.
Mangano JJ, Sherman JD. Elevated in vivo strontium-90 from nuclear weapons test fallout among cancer decedents: a case-control study of deciduous teeth. Int J Health Serv. 2011; 41(1): 137-58.
Mangano JJ, Gould JM, Sternglass EJ, Sherman JD, McDonnell W. An unexpected rise in strontium-90 in US deciduous teeth in the 1990s. Sci Total Environ. 2003; 317(1-3): 37-51.
Froidevaux P, Geering JJ, Valley JF. 90Sr in deciduous teeth from 1950 to 2002: the Swiss experience. Sci Total Environ. 2006; 367(2-3): 596-605.
Slayton RL, Warren JJ, Kanellis MJ, Levy SM, Islam M. Prevalence of enamel hypoplasia and isolated opacities in the primary dentition. Pediatr Dent. 2001; 23(1): 32-6.
Franco KM, Line SR, Moura-Ribeiro MV. Prenatal and neonatal variables associated with enamel hypoplasia in deciduous teeth in low birth weight preterm infants. J Appl Oral Sci. 2007; 15(6): 518-23.
Norén JG, Gillberg C. Mineralization disturbances in the deciduous teeth of children with so called minimal brain dysfunction. Swed Dent J. 1987; 11(1-2): 37-43.
Aoba T, Fejerskov O. Dental fluorosis: chemistry and biology. Crit Rev Oral Biol Med. 2002; 13(2): 155-70.
Needleman HL, Schell A, Bellinger D, Leviton A, Allred EN. The long-term effect of exposure to low doses of lead in childhood: An 11-years following-up report. N Engl J Med. 1990; 322(2): 83-88.
Kim R, Hu H, Rotnitzky A, Bellinger D, Needleman H. A longitudinal study of chronic lead exposure and physical growth in Boston children. Environ Health Perspec. 1995; 103: 952-57.
Magnus P, Irgens LM, Haug K, Nystad W, Skjaerven R, Stoltenberg C. Cohort profile: The Norwegian Mother and Child Cohort Study (MoBa). Int J Epidem. 2006; 35(5): 1146-50.
Golding J, Pembrey M, Jones R. ALSPAC--the Avon Longitudinal Study of Parents and Children. I. Study methodology. Paediatr Perinat Epidem. 2001; 15(1): 74-87.
Polanska K, Hanke W, Jurewicz J, Sobala W, Madsen C, Nafstad P, Magnus P. Polish mother and child cohort study (REPRO_PL) - Methodology of follow-up of the children. Int J Occup Med Environ Health (IJOMEH). 2011; 24(4): 391-8.
Folkehelseinstituttet: http://www.fhi.no/morogbarn (avlest 10.10. 2011).
Rønningen KS, Paltiel L, Meltzer HM, Nordhagen R, Lie KK, Hovengen R, Haugen M, Nystad W, Hoppin JA, Magnus P. The biobank of the Norwegian Mother and Child Cohort Study: a resource for the next 100 years. Eur J Epidemiol. 2006; 21(8): 619-25.
Adresse: Kristin S. Klock, Institutt for klinisk odontologi, Universitet i Bergen, Postboks 7800, 5020 Bergen. E-post: Kristin.Klock@iko.uib.no
Artikkelen har gjennomgått ekstern faglig vurdering.
Tvinnereim HM, Langseth MR, Klock KS. Melketenner som kilde til biomarkører i epidemiologisk forskning. Nor Tannlegeforen Tid. 2014; 124: 552-556.
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Meyer
Tvinnereim H, Rørvik
Langseth M, S.
Klock K. Melketenner som kilde til biomarkører i epidemiologisk forskning. Nor Tannlegeforen Tid. 2014;124:552-556. doi:10.56373/2014-7-9