Antibakterielle fyllinger - hvor står vi i dag?
Plastbaserte fyllingsmaterialer tiltrekker seg bakterielt plakk i større grad enn mange andre materialer, noe som medfører øket risiko for sekundærkaries. Odontologisk forskning har derfor lenge vært opptatt med å utvikle slike materialer med en innebygget antibakteriell virkning. Én metode har vært å tilsette løselige antibakterielle stoffer i resindelen av kompositter og adhesiver. Det har dreiet seg om desinfeksjonsmidler og antiseptika som klorheksidin, benzalkonium, triclosan, cetylpyridin og octenidin, men også mindre kjente stoffer som epigallokatekin gallat, en antioksidant fra grønn te. Andre metoder har vært å kryssbinde antibakterielle monomerer i resin- eller fyllstoffdelen. Sølv- eller polyetylen-nanopartikler blir også brukt. En rekke laboratorieeksperimenter gjennom mange år har vist en antibakteriell sone rundt prøvelegemer av slike materialer. Problemet har vært at utsivingen av løselige antibakterielle stoffer avtar etter en viss tid og at integrerte stoffer bare har en overflateeffekt. En annen vanskelighet har vært å komme frem til en virksom konsentrasjon av antibakterielle stoffer som ikke spolerer materialets mekaniske egenskaper. Bruk av nanopartikler har medført økt oppmerksomhet om toksiske forhold. På tross av slike vanskeligheter drives stadig avansert kjemisk og materialteknisk forskning på dette området både i Vesten og i Japan og Kina. Flere forskere gir uttrykk for optimisme med hensyn til å kunne utvikle klinisk anvendbare antibakterielle fyllingsmaterialer, men foreløpig mangler pålitelig klinisk utprøving av nyutviklede materialkombinasjoner.
Medisinsk-odontologisk forskning er opptatt av hvilke bivirkninger biomaterialer kan ha på omgivende vev eller på organismen som helhet. Innen odontologien har det dreiet seg om frigjorte komponenter fra dentale materialer ut fra en toksisk/allergisk synsvinkel. Det går imidlertid an å betrakte biomaterialer ut fra en motsatt synsvinkel: kan frigjorte komponenter ha en ønsket og gunstig effekt? Det har vært nærliggende å tenke seg restaureringsmaterialer med en antibakteriell virkning som kan redusere muligheten for karies og gingivitt.
Denne problematikken er langt fra ny. Allerede på slutten av 1800-tallet ble det observert at metaller som sølv, kopper og kvikksølv hadde drepende effekt på mikrober. Man kalte dette fenomenet for en oligodynamisk effekt, dvs. evne til å drepe eller hemme vekst av mikroorganismer i små konsentrasjoner (oligo = få, lite). Eldre tannleger vil kanskje huske bruken av kopperamalgam, som var et nyttig hjelpemiddel mot sekundærkaries på vanskelig tilgjengelige steder, men med lite ønskelige estetiske og toksikologiske egenskaper. Sølv i mange varianter har også lenge vært anvendt mot karies, fra sølvnitrat allerede før år 1900 til sølvpartikler av mikrostørrelse og sølvpartikler av nanostørrelse i henholdsvis kompositter og adhesiver etter år 2000 (1).
På denne bakgrunn er det etter hvert utført omfattende eksperimentell forskning for å utvikle restaureringsmaterialer som kan frigi antibakterielle komponenter over tid og i tilstrekkelig konsentrasjon til å hemme dannelsen av dentalt bakterieplakk. Maksimale antibakterielle egenskaper og minimale toksiske egenskaper er imidlertid vanskelig å forene med at hovedkravet til et godt restaureringsmateriale er mekanisk og kjemisk stabilitet, mens en antimikrobiell effekt utenfor overflaten forutsetter frigjorte komponenter. Hensikten med den følgende oversikten er å gjennomgå de idéene som har gjort seg gjeldende innen forskningen på dette området. Det vil bli lagt vekt på problematikken knyttet til resinbaserte restaureringsmaterialer.
Tidlige observasjoner av antibakteriell effekt
Shay og medarbeidere (1956) gjorde rede for eksperimenter utført i første halvpart av 1900-tallet der diverse dentalmaterialer ble testet på aktuelle bakterier med hensyn til baktericid effekt. Dette ble utført ved å måle klarsoner i nærheten av materialet på bakterielle agarskåler, en metodikk som har vært anvendt helt opp til våre dager (figur 1). Disse forfatterne gjorde selv liknende forsøk med laktobaciller og streptokokker og fant antibakterielle egenskaper for materialer som kopperamalgam, koppersement, sølvamalgam og gullmaterialer, de siste avhengig av forbehandlingen (2). I 1970-årene ble problemstillingen tatt opp av tyske forskere som påviste at hemningen av bakterievekst var større for kopperholdige sementer enn for ikke kopperholdige, og at også silikatsement hemmet bakteriell vekst, mens kompositter tilsynelatende stimulerte slik vekst (3,4). Norske forskere fant at mange resinbaserte materialer nok kunne ha antibakterielle egenskaper i starten, men at slike egenskaper raskt forsvant etter lagring i saltvann. Det var også stor variasjon i den antibakterielle virkningen både mellom materialtyper og mellom bakterietyper som ble testet (5). Senere testing av en rekke restaureringsmaterialer in vitro har vist en betydelig antibakteriell effekt av sementer med stort sinkoksidinnhold og av glassionomersementer.
Effekten ble tilskrevet frisetting av fluorid og sink-kationer (6). Kortidsforsøk på skolebarn bekreftet høyere andel av mutans-streptokokker i plakk fra kompositter sammenliknet med tilsvarende fra amalgam og glass-ionomer (7). Andre kliniske forsøk sammenliknet tenner med klasse III komposittfyllinger med subgingival avgrensning og tenner med intakt tannemalje med hensyn til plakk og gingivitt. Disse forsøkene kunne riktignok ikke påvise en øket plakkmengde på slike fyllinger direkte, men eksudatmengden fra gingivallommen var større enn på tenner med naturlig emalje, noe som ble tatt som tegn på en begynnende gingivitt (8).
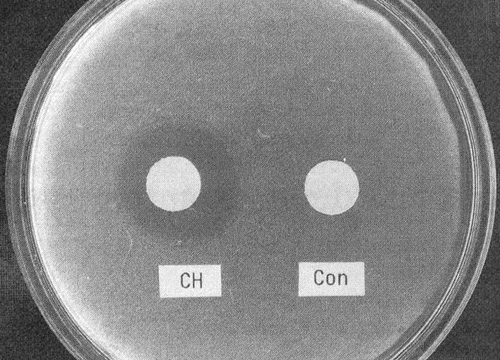
Figur 1. Resultater fra agar diffusjonstest med Streptococcus mutans. Runde prøvelegemer av eksperimentell kompositt med klorheksidin (CH) og konvensjonell kompositt (con). Klorheksidin siver ut og hindrer bakterievekst (mørk skygge) rundt prøvelegemet. Gjengitt med tillatelse fra Dental Materials (referanse 10).
Observasjoner av denne art førte til tanken om å supplere resinbaserte materialer med baktericide substanser eller å anvende antimikrobielle monomerer som kopolymerer. Tilsetting av fluorid var også en mulighet, som en parallell til den antimikrobielle effekten som oppnås ved frigjort fluorid fra glass-ionomer. Forsøk med fluoridholdige kompositter gav imidlertid ingen målbar antibakteriell effekt (9).
Antibakterielle stoffer i polymerdelen av kompositter
I 1980- og -90-årene ble det utført en rekke eksperimenter med å tilsette løselige antimikrobielle stoffer til dentale kompositter og bonding-systemer. Hensikten var å komme frem til estetisk akseptable materialer som hadde en hemmende effekt på sekundærkaries og som samtidig var motstandsdyktige mot fysiske og kjemiske påkjenninger i munnhulen. Imazato (2003) refererer til japansk forskning som påpeker den manglende antibakterielle effekten av kjente dentale monomerer som HEMA, Bis-GMA, TEGDMA, UDMA, og MMA (se tabell 1) ofte med Streptococcus mutans som prøvebakterie (10). I katalysatorsystemene kunne det nok finnes stoffer som for eksempel benzoylperoksid og kamforokinon med en viss antibakteriell virkning, men konsentrasjonen i de aktuelle materialene var for liten til å ha klinisk betydning. Det ble derfor utført en rekke in vitro forsøk med å tilsette løselige antimikrobielle midler til de aktuelle monomerene (11). Det var tale om kjente desinfeksjonsmidler, antibiotika, uorganiske stoffer med oligodynamisk effekt (tabell 2) og visse antibakterielle monomerer (tabell 1).
Vanlige monomerer: |
|
|---|---|
Bis-GMA |
Bisfenol A glycidyl metakrylat |
MMA |
Metyl metakrylat |
TEGDMA |
Trietylenglycol dimetakrylat |
UDMA |
Uretandimetakrylat |
HEMA |
Hydroksyetyl metakrylat |
EDMA |
Etylen dimetakrylat |
Antibakterielle monomerer: |
|
MDPB |
12-metakryloyloxydodecylpyridin bromid* |
DMAE-CB |
metakryloyloxyletyl cetyl dimetyl ammoniumklorid** |
* I kompositt-og bondingmaterialer
** I bondingmaterialer
Stoff |
Tilsatt kompositter |
Tilsatt bondingmaterialer |
|
|---|---|---|---|
Resindelen |
Fyllstoffdelen |
||
Benzalkoniumklorid |
+ |
+ |
|
Cetylpyridinklorid |
+ |
+ |
|
Klorheksidin |
+ |
+ |
|
Glutaraldehyd |
+ |
||
Chitosan |
+ |
||
Triclosan |
+ |
||
2-furanon |
+ |
||
Oktenidin dihydroklorid |
+ |
||
EGCD (Epigallokatekin gallat) |
+ |
+ |
|
Vancomycin |
+ |
||
Metronidazol |
+ |
||
Sølv (Ag) |
+ |
||
Sinkoksid (ZnO) |
+ |
||
Nanosølv (AgNP) |
+ |
||
QPEI |
+ |
+ |
|
Benzalkonium og cetylpyridin klorid tilhører gruppen kvartære ammoniumforbindelser. Klorheksidin er et biguanid antiseptikum. Glutaraldehyd er et desinfeksjonmiddel på aldehydbasis. Chitosan er et lineært polysakkarid fra skalldyr og brukes blant annet som plantevernmiddel. Triclosan er et bisfenol antiseptikum og antiplakkmiddel. 2-furanon er et heterocyklisk organisk stoff med antibakterielle egenskaper. Oktenidin er et overflateaktivt antiseptikum. Epigallokatekin gallat er en karbonsyreester fra grønn te, antioksidant og antibakteriell. QPEI er kvartære polyetylen nanopartikler | |||
Eksempelvis ble det eksperimentert med desinfeksjonsmidlet klorheksidin som tilsetning til lysherdende monomerer av HEMA, TEGDMA, UDMA. Konsentrasjonen ble balansert slik at mekaniske egenskaper ble akseptable, samtidig som det ble konstatert en redusert vekst av biofilm på en in vitro modell som tilsvarte munnhulens miljø. Det ble også observert nedsatt tendens til mikrolekkasje ved mikroskopiske undersøkelser på bovine tenner. Virkningen avtok imidlertid etter et par uker, når utsivingen av klorheksidin avtok (12). Også epigallokatekin gallat (EGCG) (figur 2) gav antibakteriell virkning til polymeriserte produkter av dentale monomerer (13). EGCG er en antioksidant i grønn te som er tillagt mange positive egenskaper innen medisin og alternativ medisin, blant annet antibakterielle. Videre ble det utviklet eksperimentelle monomerer som egnet seg til å kombineres med chitosan, som er et polysakkarid fra skalldyr med antibakteriell virkning (14). Andre monomerer ble kombinert med furanon, et heterocyklisk stoff med flere biologisk gunstige egenskaper, blant annet antibakterielle (15).
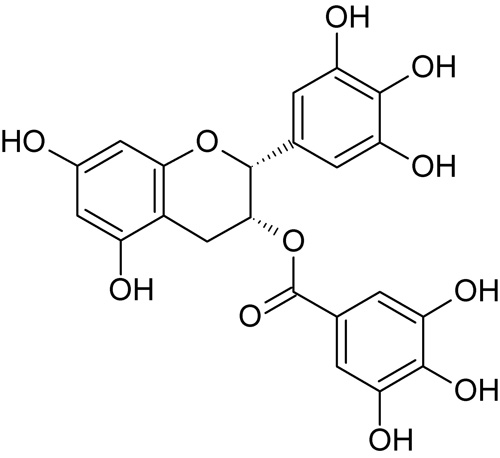
Figur 2. Strukturformel for epigallokatekin gallat (EGCG), et planteekstrakt fra grønn te med antioksiderende, antiinflammerende og antimikrobiell virkning. Tilsatt eksperimentelle resinbaserte materialer.
Også oktenidin dihydroklorid (figur 3), et overflateaktivt stoff med antibakterielle egenskaper, er blitt tilsatt eksperimentelle kompositter. Rupf et al (2012) festet slike kompositter til ytterflaten på individuelle akrylskjeer som frivillige personer brukte noen dager. Både scanningmikroskopi av biofilmen og bedømmelse av vitaliteten ved fluorescensemikroskopi viste at mikrobeinnholdet sank betydelig, avhengig av oktenidinkonsentrasjonen. Kunstig aldring av prøvelegemene tydet heller ikke på noen ugunstig effekt på bindingen mellom fyllstoff og monomerer. Forfatterne påpeker imidlertid at kliniske langtidsundersøkelser mangler (16). Liknende forsøk ble gjort ved tilsetting av andre antibakterielle stoffer, inklusiv antibiotika, som alle viste en positiv, men tidsavgrenset effekt med hensyn til plakkvekst.
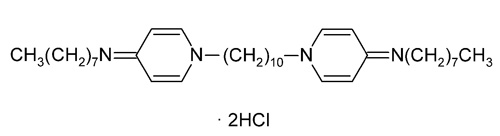
Figur 3. Strukturformel av oktenidin dihydroklorid. Brukes som hud- og slimhinnedesinfeksjon og antiseptisk sårbehandling som 0,1 % løsning i vann. Tilsatt eksperimentelle resinbaserte materialer.
En annen tilnærmingsmetode var å integrere antibakterielle monomerer i det polymere nettverket med funksjon som kontaktinhibitor mot bakterier på overflaten av materialet. En monomer med slike egenskaper er 12-methacryloyloxydodecylpyridin bromid (MDPB). MDPB er en analog til cetylpyridinklorid som er mye brukt i skyllemidler og tannpastaer og lar seg polymerisere sammen med det øvrige nettverket av monomerer i kompositter (figur 4) (17). Virkningen av MDPB-tilsetning hadde imidlertid begrenset verdi fordi den bakteriehemmende virkningen var avhengig av direkte overflatekontakt og var mer bakteriostatisk enn baktericid.
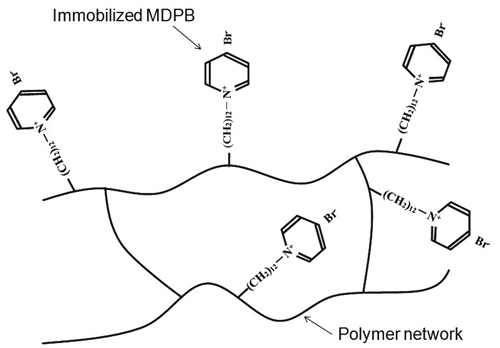
Figur 4. Den antibakterielle monomeren MDPB (12-metakryloyloxydodecylpyridin bromid) er festet til det polymere nettverket og lekker ikke ut. Tilsatt eksperimentelt adhesiv. Gjengitt med tillatelse fra Dental Materials Journal (referanse 17).
Antibakterielle stoffer i fyllstoffdelen av kompositter
Det ble også gjort forsøk på å inkorporere antibakterielle stoffer i fyllstoffpartiklene, som utgjør 70 - 90 vektprosent av kompositter. Titanpartikler ble prøvd, men oftest var det tale om å anvende sølv inkorporert i fyllstoffpartikler av silisiumdioksid og silisiumholdig glass på linje med bruk av sølvholdige materialer i bruksgjenstander som kjøkkenutstyr, klær osv. De tradisjonelle fyllpartiklene ble delvis byttet ut med sølvholdig zeolitt (mikroporøs aluminiumsilikat), silikat, zirkoniumfosfat eller apatitt (10). Syafiuddin og medarbeidere (1997) utviklet et sølv- og sinkholdig apatittbasert, antibakterielt fyllstoff som ble tilsatt et kommersielt komposittmateriale. Så la man klasse III fyllinger på ekstraherte humane premolarer og observerte kariesutviklingen in vitro. Det ble konstatert betydelig mindre karies i forhold til kontroller, særlig mot det gingivale. Men fyllingene hadde en tendens til misfarging, noe som ble tilskrevet sølvinnholdet (18). Prepolymerisert MDPB ble også anvendt som supplement til fyllstoffene, men gav uklare resultater med hensyn til bakteriehemning (19).
En fellesnevner ved tilsetting av løselige antibakterielle stoffer til resin- eller fyllstoffdelen av kompositter var at man kunne påvise en antibakteriell effekt i laboratorieforsøk, men at virkningen var kortvarig. Man måtte også regne med en kvalitetsreduksjon med hensyn til mekaniske egenskaper for det ferdigpolymeriserte produktet. Heller ikke forsøk på å blande inn bakteriehemmende monomerer blant de regulære monomerene førte til varige antibakterielle egenskaper.
Antibakterielle stoffer i emalje- og dentinbindere
Selvetsende bonding-systemer har vært ansett gunstig for å eliminere restbakterier på grunn av primernes lave pH, men risikoen for at syrebestandige restbakterier som laktobaciller kan overleve, har bidratt til at slike systemer ikke har vært ansett som pålitelige i antibakteriell sammenheng (20). I årenes løp er det derfor eksperimentert med en rekke antibakterielle stoffer med sikte på å inaktivere restbakterier i kavitetsdentinet før selve restaureringsprosessen. Det foreligger rikelig informasjon om den desinfiserende virkning in vitro av stoffer som sølvnitrat, fenol og tymol, fluorid- og EDTA-holdig benzalkoniumklorid, natrium hypokloritt, hydrogen peroksid, klorheksidin gluconat m.fl., men klinisk oppfølgning savnes (21).
Desinfeksjonsproblematikken i dentinkaviteten faller sammen med interessen for antimikrobielle stoffer tilsatt selve bondingmaterialene både med sikte på å inaktivere restbakterier i dentin og å forhindre mikrolekkasje. I store trekk består bondingmaterialer av de samme monomerene som kompositter med tilsetting av flyktige stoffer som aceton, etanol eller vann. Det har vært gjort laboratorieforsøk med å tilsette metronidazol og vancomycin til bondingmaterialer (22), som en parallell til tilsetting av gentamycin til bensement ved ortopedisk/kirurgsk behandling (23), men antibiotika har ellers ikke vært aktuelt i denne sammenheng.
Derimot har et liknende utvalg av desinfeksjonsmidler som for kompositter vært inkorporert i bondingmaterialene. I tillegg har det vært eksperimentert med tilsetting av glutaraldehyd og EGCG, som begge har vist hemning av relevante munnhulebakterier in vitro (11). Du og medarbeidere (24) påviste at EGCG-tilsetning i dentale adhesiver gav hemning av S. mutans målt ved direkte kontakt og ved scanning elektronmikroskopi av biofilm på prøvelegemer både rett etter herding og en måned etterpå. Det var ingen negativ innvirkning på bondstyrken inntil 6 måneder etter ferdig herding. Disse forfatterne er optimistiske med hensyn til å kunne utvikle klinisk anvendbare antibakterielle bondingsystemer. Hittil har imidlertid kommersielt tilgjengelige antibakterielle materialer vært begrenset til glutaraldehydholdige bondingmaterialer bl.a. Gluma, Bayer Dental, som ble utviklet for 25 år siden. Disse materialene viste klare bakterielle hemningssoner ved agardiffusjon (jfr. figur 1) etter ferdig herding. In vivo forsøk med Gluma på apetenner viste også gode resultater med hensyn til eliminering av restbakterier og histologisk bedømt dempning av pulpal inflammasjon (25). De glutaraldehydholdige materialene er imidlertid trukket fra markedet (10).
Også ortodontistene har tatt opp problematikken knyttet til bondingmaterialer, fordi mikroorganismer kan innvirke på festet for brackets og føre til karies. Japanske forskere viste at benzalkoniumklorid tilsatt en metylmetakrylat-basert ortodontisk bondingresin (Superbond C&B) gav en inhiberingssone ved agardiffusjon i relasjon til visse streptokokker (26). Effekten var avhengig av konsentrasjonen og minket over tid. Tidsgrensen for forsøkene var 180 dager. Deres forskningsrapport inkluderte også cytotoksiske prøver. De konsentrasjoner av benzalkoniumklorid som hadde best antibakteriell virkning, var også mest cytotoksisk. Forfatterne mente å kunne finne frem til en konsentrasjon med en akseptabel virkning både med hensyn til antibakteriell virkning og cytotoksisitet, men påpekte at det måtte ytterligere forskning til før dette bondingsystemet kunne testes klinisk.
I likhet med kompositter er polymeriserbare antibakterielle monomerer blitt tilsatt adhesiver for å oppnå baktericid virkning uten at noe stoff siver ut. Et eksempel er en kvartær ammonium monomer, metakryloyloxyletyl cetyl dimetyl ammoniumklorid (DMAE-CB), som kan polymeriseres sammen med øvrige monomerer. En viss prosentdel av denne monomeren gav kontaktbasert antibakteriell virkning til en kommersiell ortodontisk adhesiv (Single Bond 2, 3M Espe) uten at det gikk ut over bondingkvaliteten. Dette ble testet i laboratoriet på humane 3. molarer (27). Forskerne regnet imidlertid med at restmonomer av DMAE-CB kunne være tilstede og analyserte derfor eluater fra det polymeriserte produktet med hensyn til toksisitet på fibroblastceller (L929) i kultur. Cytotoksisiteten for fibroblastene var sammenliknbar med eluater fra vedkommende adhesiv uten DMAE-CB, men forfatterne presiserer likevel at man bør undersøke videre for å klargjøre effekten på odontoblastrelaterte celler. Dette forhold illustrerer en felles problemstilling for eksperimentelle antibakterielle adhesiver nemlig å finne en konsentrasjon som balanserer antibakteriell virkning med toleranse av pulpale celler.
Nanoteknologi
I de siste årene er det kommet et nytt aspekt inn i diskusjonen om antibakterielle restaureringsmaterialer idet nanopartikler er tatt i bruk som baktericid ingrediens. Nanomaterialer er definert som partikler med minst en dimensjon mellom 1 og 100 nanometer (nm, 1 nm = 10 - 9 m).
Nanopartikler har større overflate per vektenhet enn større partikler og lettere absorpsjon gjennom cellemembraner og oppnår dermed øket biologisk aktivitet. Den baktericide effekten av produkter som for eksempel nano sølvpartikler (AgNP) er derfor betydelig større enn for sølv i andre former. Effekten kommer fra ionisert sølv som stammer fra nanosølvpartikler på overflaten eller integrert i materialene.
Dette har ført til forsøk på å utvikle kompositter der nano sølvpartikler er integrert i resindelen for å gi varig baktericid effekt (28). Mekanismene antas å være at sølv ioniseres, angriper bakterienes cellevegg og cellemembraner, og binder seg dessuten til proteiner som regulerer enzymsystemer, slik at bakteriene går i oppløsning (29). Fyllstoffer i nanoform har også vakt interesse fordi slike partikler kan gi et tettere materiale og dermed en glattere overflate, noe som i sin tur gir mindre mulighet for bakteriell adhesjon (30). Israelske forskere har anvendt kvartær polyetylen-imin (QPEI) nanopartikler som kopolymer i kompositter, noe som har gitt en sterk antibakteriell kontaktaktivitet uten at partiklene lekker ut og uten at mekaniske egenskaper blir affisert (31). De samme forskerne har også utført kliniske eksperimenter med avtakbare akrylskinner på frivillige pasienter der det var festet QPEI-holdige kompositter. Resultatene viste at over 50 % av bakteriene i biofilmen på slike kompositter dør, sammenliknet med kompositter uten QPEI (32). Videre har kinesiske forskere nylig kombinert virkningen av nanosølv med den antibakterielle monomeren MDPB i bondingsystemer (33). De kunne påvise en betydelig bakteriell inhibisjon når begge substanser var tilsatt primer og adhesiv samtidig. Deres prosjekt inkluderer også eksponering av fibroblaster i kultur for å ha kontroll med toksisiteten. De ser gode muligheter for at en slik kombinasjon av antibakterielle virkestoffer kan komme til anvendelse i adhesiver, fissurforseglere, sementer og kompositter.
Nanopartikler og toksisitet
Nano sølvpartikler har en dokumentert antibakteriell virkning, men noe mindre på Gram-positive bakterier som Staphylococcus aureus enn på Gram-negative (f.eks. Escherichia coli). Det forklares med forskjeller i celleveggen mellom de to typer, i det Gram-positive bakterier har et tykkere peptidoglycanlag, som er negativt ladet og derfor fanger opp større mengder sølvioner (34). I alle tilfeller er små nanopartikler mer toksisk enn større fordi små partikler lettere passerer bakterienes cellevegger og cellemembraner. Toksisiteten beror på at sølvatomer bindes til thiolgrupper (-SH) på enzymer som dermed deaktiveres. Det kan være tale om nøkkelenzymer som har med energi-generering og med ionetransport over bakterienes cellemembran samt forstyrrelse av bakterienes DNA-struktur (35).
Det ligger i sakens natur at nanopartikler også er toksisk overfor humane celler. Det kan riktignok synes som humane celler har større motstandsevne enn bakterieceller, men på dette området er det mange uavklarte spørsmål (36). Myndighetenes oppmerksomhet er i alle fall skjerpet når det gjelder toksisitet av nanopartikler, særlig nano sølvpartikler som etter hvert finnes i en rekke hverdagslige og medisinske bruksgjenstander som klær, kjøleskap, bandasjer, masker etc. EU-kommisjonen har en ekspertgruppe som vurderer helserisiko og miljømessige effekter av nanosølv som bakteriedrepende middel. Lovende resultater med hensyn til antibakterielle egenskaper av dentale plastmaterialer knyttet til nanoteknologi kan derfor møte hindringer knyttet til nettopp denne teknologien.
Sluttbemerkninger
Den kliniske bakgrunnen for de omtalte forskningsrapportene er den gamle observasjonen at det på resinbaserte restaureringsmaterialer dannes mer bakterielt plakk enn på andre materialer og dermed øker risikoen for sekundærkaries og gingivitt. Materialet for denne oversikten er i alt vesentlig basert på søk i PubMed, Medline, under varianter av søkeordene «antibacterial resin based dental materials». Nyere oversiktsartikler har vært nyttig for å finne frem til de mest relevante referanser. De enkelte rapportene er så valgt ut etter skjønn for å gi et inntrykk av den forskningsaktivitet som har gjort seg gjeldende for å gi slike materialer antibakterielle egenskaper. Den enkleste metoden har vært å tilsette kjente desinfeksjonsmidler eller antiseptika. En sakte utsiving av slike midler vil da kunne hemme veksten av bakterier. Et stort antall forskningsrapporter over mange år bekrefter da også en slik effekt. Ulempene er at effekten avtar etter en tid og at det er vanskelig å finne en virksom konsentrasjon av det antibakterielle middelet som ikke forstyrrer materialets mekaniske egenskaper. Antibiotika har ikke spilt noen stor rolle i denne sammenhengen, blant annet på grunn av resistensproblematikken.
Integrering av antibakterielle monomerer i resin- og fyllstoffdelen har også sine begrensninger fordi effekten er begrenset til overflaten. Anvendelse av sølv i forskjellige former har den ønskede antibakterielle effekt, men er lite anvendelig fordi sølv gir misfarging. I tillegg kommer begrensninger knyttet til toksiske effekter av nanosølv. Ingen nyutviklede kompositter av denne art er kommet til klinisk utprøving, langt mindre på markedet. Bare enkeltstående eksperimentelle kompositter er prøvd ut på tannmateriale, og da på ekstraherte tenner (18). Heller ikke forsøkene på å anvende antibakterielle adhesiver har ført til klinisk anvendelse etter at et par eldre, glutaraldehyd-holdige materialer ble trukket fra markedet. Nyere rapporter tyder heller ikke på at klinisk utprøving av antibakterielle restaureringsmaterialer er like rundt hjørnet. En gjennomgang av 128 publikasjoner om dette tema ved Cochrane Database fra 2009 inneholdt ikke én som kunne inkluderes når vitenskapelige kriterier for klinisk testing ble lagt til grunn (37). Også nyere vurderinger av forskningsaktiviteten på dette området påpeker mangelen på klinisk utprøving (38). Dette forhold understrekes også av aktive forskere selv (39).
Ikke desto mindre vitner nyere forskningsrapporter om stor aktivitet med avansert kjemisk og materialteknisk kompetanse. Mange forskere tar i bruk fantasifull metodikk og uttrykker stor optimisme med henblikk på å komme frem til antibakterielle resinbaserte fyllingsmaterialer. Det gjelder både tilsetting av desinfeksjonsmidler som octenidin (16) og EGCG (24) og kombinasjoner av antibakterielle monomerer og nanopartikler (33). For en observatør kan de materialtekniske og kjemiske detaljene være komplisert å forstå, men prinsippene er enkle, og den kliniske relevansen er udiskutabel. Det blir spennende å se hvordan dette feltet vil utvikle seg i årene som kommer.
Takk
Takk til Ketil Kvam og Jan Tore Samuelsen for hjelp med figurene.
English summary
Jacobsen N.
Antibacterial fillings. Where are we today?
616-22.
Bacterial plaque adheres to resin based restorative materials to a larger extent than many other biomaterials, increasing the risk of secondary caries. Therefore, research has focused on adding antibacterial activity to such materials. One method has been to add soluble disinfectants such as chlorhexidine, benzalconium chloride, triclosan, octenidin, or antioxidants such as epigallocathechin to the resin part of composites and adhesives. Integrating antibacterial monomers or adding silver- or polyethylene nanoparticles to the resin or filler part have also been investigated, and a number of in vitro experiments have shown antibacterial activity of test samples of such materials. However, the leaching of soluble antibacterial substances tends to diminish over time and integrated antibacterials exhibit only surface activity. Another difficulty has been to determine concentrations of antibacterial substances not disturbing the mechanical properties of the material. In addition, a possible risk associated with nanoparticles must be taken into account.
In spite of these difficulties advanced chemical and technical research activity addressing this topic takes place both in the Western world, and in Japan and China. Many researchers are optimistic with regard to a successful development of antibacterial resin based restoratives. At present, however, clinical trials are missing.
Hovedpunkter | |
|---|---|
· |
Det vokser noe mer plakk på resinbaserte restaureringsmaterialer enn på mange andre materialer. |
· |
Kjemisk/materialteknisk forskning er derfor opptatt med å gi slike materialer antibakterielle egenskaper. |
· |
Foreløpig mangler klinisk utprøving av nyutviklede materialer med denne egenskap. |
professor emeritus. Nordisk institutt for odontologiske materialer (NIOM)
Referanser
Peng JJ-Y, Botelho MG, Matinlinna JP. Silver compounds used in dentistry for caries management: A review. J Dent. 2012; 40: 531 - 40.
Shay DE, Allen TJ, Mantz RF. The antibacterial effect of some dental restorative materials. J Dent Res. 1956; 35: 25 - 32.
Schmalz G. Der Einfluss verschiedener Frontzahnfüllungsmaterialien auf das In-vitro-Wachstum von Streptococcus mutans. Dtsch Zahnartz Z. 1977; 32: 575 - 9.
Schmalz G, Rotgans J. Antimicrobial properties of cements with and without copper content. Dtsch Zahnarztl Z. 1977; 32: 760 - 2.
Ørstavik D, Hensten-Pettersen A. Antibacterial activity of tooth-colored dental restorative materials. J Dent Res. 1978; 57: 171 - 4.
Scherer W, Lippman N, Kaim J. Antimicrobial properties of glass-ionomer and other restorative materials. Oper Dent. 1989; 14: 77 - 81.
Svanberg M, Mjõr IA, Orstavik D: Mutans streptococci in plaque from margins of amalgam, composite, and glassionomer restorations. J Dent Res. 1990;69: 861 - 4.
van Dijken JWV, Sjöström S, Wing K. Development of gingivitis around types of composite resin. J Clin Periodontol. 1987; 14: 257 - 60.
Yap AU, Khor E, Foo SH. Fluoride release and antibacterial properties of new-generation toothcolored restoratives. Oper Dent. 1999; 24: 297 - 305.
Imazato S. Antibacterial properties of resin composites and dentin bonding systems. Dent Mater. 2003; 19: 449 - 57.
Chen L, Shen H, In Suh B. Antibacterial dental restorative materials: A state-of-the-art review. Am J Dent. 2012; 25: 337 - 46.
Leung D, Spratt DA, Pratten J, Gulabivala K, Mordan NJ, Young AM. Chlorhexidine-releasing methacrylate dental composite materials. Biomaterials. 2005; 26: 7145 - 53.
Mankovskaia A, Levesque CM, Prakki A. Catechin-incorporated dental copolymers inhibit growth of Streptococcus mutans. J Appl Oral Sci. 2013; 21: 203 - 7.
Kim JS, Shin DH. Inhibitory effect on Streptococcus mutans and mechanical properties of the chitosan containing composite resin. Restor Dent Endod. 2013; 38: 36 - 42.
Weng Y, Howard L, Guo X, Chong VJ, Grepory RL, Xie D. A novel antibacterial resin composite for improved dental restoratives. J Mater Med. 2012; 23: 1553 - 61.
Rupf S, Balkenhol M, Sahrhage T et al. Biofilm inhibition by an experimental dental resin composite containing octenidine dihydrochloride. Dent Mater. 2012; 28: 974 - 84.
Imazato S. Bio-active restorative materials with antibacterial effects: new dimension of innovation in restorative dentistry. Dent Mater J. 2009; 28: 11 - 9.
Syafiuddin T, Hisamitssu H, Toko T, Igarashi T, Goto N, Fujishima A, Miyazaki T. In vitro inhibition of caries around a resin composite containing antibacterial filler. Biomaterials. 1997; 18: 1051 - 7.
Ebi N, Imazato S, Noiri Y, Ebisu. Inhibitory effect of resin composite containing bactericide-immobilized filler on plaque accumulation. Dent Mater. 2001; 17: 485 - 91.
Imazato S, Imai T, Ebisu S. Antibacterial activity of propriety self-etching primers. Am J Dent. 1998; 11: 106 - 8.
Shafiei F, Memarpour M. Antibacterial activity in adhesive dentistry. A literature review. Gen Dent. 2012; www.agd.org 346 - 56.
Kodou Y, Obara K, Kawashima T, Kubota M, Abe S, Endo T, Komatsu M, Okuda R. Addition of antibacterial agents to MMA-TBB dentin bonding systems - influence on tensile bond strength and antibacterial effect. Dent Mater J. 2000; 19: 65 - 74.
Stefansdottir A, Johansson Å, Lidgren L, Wagner Ph, W-Dahl A. Bacterial colonization and resistance patterns in 133 patients undergoing a primary hip- or knee replacement in Southern Sweden Acta Orthop. 2013; 84: 87 - 91.
Du X, Huang X, Huang C, Wang Y, Zhang Y. Epigallocatechin-3-gallate (EE\GCG) enhances the therapeutic activity of a dental adhesive. J Dent. 2012; 40: 485 - 92.
Felton D, Bergenholtz G, Fox CF. Inhibition of bacterial growth under composite restorations following GLUMA pretreatment. J Dent Res. 1989; 68; 491 - 5.
Saito K, Hayakawa T, Kawabata R, Meguro D, Kasai K. In vitro antibacterial and cytotoxicity assessments of an orthodontic bonding agent containing benzalkonium chloride. Angle Orthod. 2009; 79: 331 - 7.
Chai Z, Li F, Fang M, Wang Y, Ma S, Xiao Y, Huang L, Chen J. The bonding property and cytotoxicity of a dental adhesive incorporating a new antibacterial monomer. J Oral Rehabil. 2011; 38 : 849 - 56.
Fan C, Chu L, Rawls HR, Norling BK, Cardenas HL, Whang K. Development of an antimicrobial resin - a pilot study. Dent Mater. 2011; 27: 322 - 8.
Hamouda M. Current perspectives of nanoparticles in medical and dental biomaterials J Biomed Res. 2012; 26: 143 - 51.
Ozak ST, Ozkan P. Nanotechnology and dentistry. Eur J Dent. 2013; 7: 145 - 51.
Beyth N, Yuodovin-Farber I, Bahir R, Domb AJ, Weiss EI. Antibacterial activity of dental composites containing quaternary ammonium polyethyleneimine nanoparticles against Streptococcus mutans. Biomaterials. 2006; 27: 3995 - 4002.
Beyth N, Yudovin-Farber I, Perez-Davidi M, Dom AJ, Weiss EI. Polyethyleneimine nanoparticles incorporated into resin composite cause cell death and trigger biofilm stress in vivo. Proc Natl Acad Sci USA. 2010; 107: 22038 - 43.
Zhang K, Imazato S, Cheng L, Liu H, Arola DD, Bai Y, Xu HH. Dual antibacterial agents of nano-silver and 12-methacryloyloxydodecylpyridinum bromide in dental adhesive to inhibit caries. J Biomed Mater Res B Appl Biomater. 2013; 101: 929 - 38.
Feng QL, Wu J, Chen GQ, Cui FZ. Kim TN, Kim JO. A Mechanistic study of the antibacterial effect of silver ions on Escherichia coli and Staphylococcus aureus. J Biomed Mater Res. 2000; 52; 662 - 8.
Lansdown AB, Silver in health care: antimicrobial effects and safety in use. Curr Probl Dermatol. 2006; 33: 17 - 34.
de Lima R, Seabra AB, Duran N. Silver nanoparticles: a brief review of cytotoxicity and genotoxicity of chemically and biogenically synthesized nanoparticles. J Appl Toxicol. 2012; 32: 867 - 79.
Pereira-Cenci T, Cenci MS, Fedorowicz Z, Marchesan MA. Antibacterial agents in composite restorations for the prevention of dental caries (Review). Cochrane Database Syst Rev. 2013; 12: CD007819
Wang Z, Shen Y, Haapasalo M. Dental materials with antibiofilm properties. Dent Mater. 2014 Feb; 30: e1 - 16.
Imazato S, Ma S, Chen JH, Xu HH. Therapeutic polymers for dental adhesives: Loading resins with bio-active components. Dent Mater. 2014: 30; 97 - 104
Adresse: Nils Jacobsen, NIOM, Sognsveien 70A, 0855 Oslo. E-post: n.j.jacobsen@niom.no
Artikkelen har gjennomgått ekstern faglig vurdering.
Jacobsen N. Antibakterielle fyllinger - hvor står vi i dag? Nor Tannlegeforen Tid. 2014; 124: 616-22.