Oral helse og kognitiv funksjon
Mus og rotter som får molarer fjernet, finner vanskeligere frem til mat i eksperimentelle labyrinter. Det har ført til spekulasjoner om en sammenheng mellom tyggefunksjon og kognitiv funksjon. Undersøkelser på unge mennesker har vist økt blodgjennomstrømning og økt nevronaktivitet i hjernen ved tygging av tyggegummi og at hukommelse og enkelte andre kognitive funksjoner blir bedre. Dette har ledet til teorier om at manglende tyggefunksjon kan ha betydning for utvikling av demens. En rekke epidemiologiske studier viser da også at tanntap og demens ofte opptrer sammen. Noen forskere har hevdet at svikt i den mastikatoriske stimulansen bidrar til svekkelse av nevroner i hjernevev, mens andre påpeker at tanntap oftest skyldes en bakteriell sykdom som periodontitt, der både infeksiøse agens og inflammatoriske vertsreaksjoner kan indusere mikrogliaceller til reaksjoner som fører til nevrondød. Inflammasjonsteorien synes å ha mest støtte blant forskerne nå, men det påpekes at de mange opplysninger om en sammenheng mellom oral sykdom og kognitiv svikt hos eldre mennesker ikke nødvendigvis betyr en kausal sammenheng, idet mange forhold hos demente mennesker kan gå ut over oral helse.
Hovedbudskap | |
|---|---|
· |
Dyreeksperimenter tyder på at tanntap har betydning for kognitiv funksjon |
· |
Kliniske undersøkelser av eldre viser en sammenheng mellom tanntap, dårlig tyggefunksjon og demens, men det er uklart om tanntap er en årsaksfaktor eller en følge |
· |
Psykologisk og nevrologisk forskning beskriver mekanismer for at periodontal inflammasjon, som er den hyppigste årsak til tanntap, kan være en risikofaktor ved nevrontap og utvikling av demens |
Kognitive funksjoner som hukommelse, konsentrasjonsevne, læreevne, språkforståelse og evne til å skifte oppmerksomhet fra en stimulus til en annen kan svekkes med alderen og gå over i demens. Det hele forklares ved forandringer i de områder av hjernen som styrer slike funksjoner, eksempelvis den prefrontale hjernebarken, som har overordnet styring når det gjelder planlegging, resonnerende og problemløsende evner. Demens kan være degenerativ, som ved Alzheimers sykdom, eller vaskulær i form av hjerneinfarkter, hyalinose i små arterioler eller hypoksi. Den vaskulære formen ble tidligere kalt åreforkalkning. I Norge anslås antall personer med demens til ca. 70 000, hvorav Alzheimers utgjør ca. 70 %. Nest hyppigst er vaskulær demens, 17 - 26 %. Før utvikling av demens er det gjerne en periode med mildere kognitiv svikt.
Tidlig utsatte områder i hjernen er tinninglappen og hippokampus, særlig det såkalte enterorhinale området, som styrer romlig hukommelse. Senere affiseres parietallappen og hele det kortikale området, som etter hvert viser atrofi og celledød (se forenklet skisse, figur 1). I hjernevev fra Alzheimerpasienter ses intracellulære fiberfloker av kjemisk forandrete tau-proteiner. Dette er proteiner som vanligvis stabiliserer nevronenes mikrotubuli, men som nå er kjemisk forandret og fører til celledød. Ekstracellulært ses det plakk av beta-amyloid protein, som er feilavspaltet fra et amyloid prekursorprotein. Amyloid er en fellesbetegnelse for utfelte proteiner som har mistet sin form. Rundt slike amyloide plakk oppstår det inflammasjon og oksidativt stress som dreper nevroner. Samtidig opptrer reduksjon av signalsubstanser som acetylkolin (1).
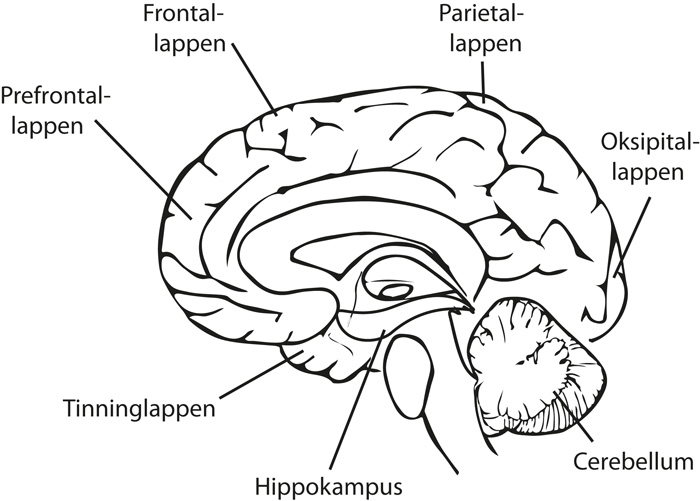
Figur 1. Forenklet skisse av hjernevev antyder noen lokalisasjoner i hjernen.
Etiologien ved Alzheimers sykdom er uklar, men det finnes flere arvelige varianter. Den mest kjente er knyttet til et gen som koder for epsilon 4-allélen av det såkalte apolipoproteinet, som er viktig for vekst og regenerasjon av celler, men som også øker risikoen for utvikling av Alzheimer. Dette proteinet finnes både i amyloide plakk og fiberfloker og bidrar til nedbrytning av nevroner. Lærebøkene påpeker at generelle helsemessige faktorer som høyt blodtrykk, kolesterol, overvekt, diabetes, røyking og alkoholisme kan være risikofaktorer for demens (2). I tillegg har helseundersøkelser av eldre antydet at tanntap med nedsatt tyggefunksjon kan være en medvirkende faktor, idet man tenker seg at stimuli som er knyttet til den mekaniske tyggefunksjonen, er av betydning for kognitiv funksjon (3). Et annet moment er at inflammasjonstrykk fra bakterielle sykdommer som periodontitt kan ha betydning for utvikling av demens og at tanntap ofte skyldes nettopp periodontitt.
Den følgende oversikten søker å gi et innblikk i forskning som tar sikte på å klargjøre relasjonen mellom kognitiv funksjon og sviktende oral helse.
Tyggeevne og kognitiv funksjon, dyreforsøk
Teoriene for en sammenheng mellom tyggeevne og kognitiv funksjon er basert på dyreeksperimenter. Japanske forskere har tatt utgangspunkt i eksperimenter på rotter og mus der dyrene lærer seg å finne frem til mat i en labyrint (radial arm maze) med forskjellige hindringer. Men når dyrene har fått fjernet molarer, gjør de flere feil, noe som kan tyde på svekket romlig hukommelse.
Dette blir satt i sammenheng med nedsatt frigjøring av nevrotransmitteren acetylkolin i den parietale hjernebarken, noe som vil minske overføring av nerveimpulser (4). Det er også påvist at kost som ikke krever tygging, fører til reduksjon av celletettheten i deler av hjernebarken og hippokampus (5). En tredje mekanisme kan være at mangelfull tygging gir en forstyrrelse av HPA-aksen (hypothalamus-pituitary-adrenal-axis) med øket plasmakonsentrasjon av kortisol, noe som har negative følger for kognitiv funksjon (6). Svekket hukommelse og læreevne blir tolket som et resultat av den reduserte sensoriske stimulansen som følger av dårlig tyggefunksjon (7). Dyreeksperimentene kan oppsummeres slik: Redusert tyggefunksjon fører til at hippokampus-nevroner går til grunne, svekker den romlige hukommelsen og gir stress som påvirker læreevnen gjennom HPA-aksen. Intakt tyggefunksjon forbedrer kognitive evner ved å aktivere nevroner i hippokampus og den prefrontale hjernebarken (8).
Eksperimentelle studier på mennesker
Undersøkelser på yngre mennesker har vist at tygging av tyggegummi øker blodtilførselen til hjernen og åpner for økt hjerneaktivitet (9), noe som er bekreftet ved bruk av funksjonell magnetisk resonans avbildning (fMRI) (10). Wilkinson og Sholey (2002) viste at tygging av tyggegummi også gav en positiv effekt på hukommelse og andre kognitive funksjoner (11), men skeptikere påpekte at kontekst-relaterte psykologiske faktorer (suging, smak) like gjerne kunne gi en positiv effekt uten tygging (12). Senere er det blitt bekreftet ved fMRI-undersøkelser at tygging virkelig øker nevronaktiviteten i den prefrontale hjernebarken og visse andre hjerneområder samtidig som kognitive prestasjoner øker (13). Scherder og medarbeidere sammenliknet protesebærere og personer med naturlig tannsett med hensyn til episodisk og semantisk hukommelse og eksekutive funksjoner. Protesebærere med svekket tyggeevne skåret dårligere på hukommelsestestene, men forfatterne var forsiktig med å trekke for bestemte konklusjoner (14). Sholey og medarbeidere undersøkte hvordan tygging av tyggegummi influerte på stressnivået under «multitasking» - ved psykologiske stresstester og ved å måle kortisol i saliva. Tygging gav bedre årvåkenhet, minsket bekymring og redusert kortisolnivå (15). Andre forskere har hatt vanskeligheter med å reprodusere den stressdempende effekten av tygging, men større årvåkenhet, hurtigere reaksjonstider og økt konsentrasjonsevne er blitt bekreftet (16).
Resultatene av de eksperimentelle studiene er således ikke entydige. Ohkubo og medarbeidere sammenfatter det slik at all bevegelsesaktivitet i det maksillofaciale området stimulerer til økt blodgjennomstrømning og aktivitet i hjernen. Det kan man observere med ikke-invasive teknikker som elektroencefalogram, fMRI og andre metodikker. Disse teknikkene kan imidlertid ikke forventes å reflektere all komplisert nevronaktivitet. På grunnlag av eksperimentelle data må derfor sammenhengen mellom tyggefunksjon og kognitiv funksjon hos mennesker sies å være en mulig, men uavklart hypotese (17).
Tanntap og kognitiv svikt, epidemiologiske undersøkelser
En rekke epidemiologiske undersøkelser har tatt opp tyggeeffekt og kognitive funksjoner, oftest i relasjon til aldring og utvikling av demens. Slike undersøkelser er basert på oralmedisinske data sammenholdt med resultater etter psykologiske tester som er utarbeidet for å avsløre kognitiv svikt på forskjellige stadier. Bergdahl og medarbeidere fant at tannløse personer skåret dårligere på den såkalte MMSE-testen (se faktaboks) enn personer med tenner, slik det kom frem i en omfattende helseundersøkelse av befolkningen i Nord Sverige («Betula-studien»). Forfatterne tolket sine funn slik at tyggefunksjon med naturlige tenner hadde betydning for kognitive funksjoner, men var åpen for visse usikkerhetsmomenter i relasjon til metodikken (18). Senere ble denne studien fulgt opp ved en tverrsnittsundersøkelse av 273 deltakere mellom 50 og 80 år med et batteri av kognitive tester kombinert med orale undersøkelser. Resultatene tydet på at episodisk og semantisk langtidshukommelse samsvarte med antall naturlige tenner hos eldre, mens den visuelt/romlige persepsjonen og hastigheten av tankevirksomhet ikke viste en slik sammenheng (19). Også andre svenske forskere har pekt på redusert tyggefunksjon som medvirkende ved aldersrelatert kognitiv svekkelse (20).
Forholdet kognitiv svikt og oral sykdom har også vært studert ved omfattende helseundersøkelser i andre land. En meget sitert longitudinell demensstudie fra USA omfattet tannjournaler, resultater fra kognitive tester og post-mortem undersøkelser av hjernevev hos eldre nonner. Nonner med få tenner hadde øket risiko for demens, men det var ikke grunnlag for å påstå en kausal sammenheng mellom tanntap og demens (21). De samme nonnene ble også testet for allélen apolipoprotein E 4, som er en viktig genetisk faktor ved utvikling av Alzheimers sykdom. Begge faktorer samtidig, dvs. både tanntap og den nevnte allélen, gav større utslag på Delayed Word Recall testen enn hver faktor for seg (22). Epidemiologiske undersøkelser fra Japan bekreftet sammenhengen mellom tanntap og kognitiv svekkelse, uten at det ble tatt stilling til hva tanntapet skyldtes (23,24). En longitudinell studie på eldre USA-veteraner tydet imidlertid på at periodontal inflammasjon, som årsak til tanntap, var en indikator for kognitiv svikt (25). Etter hvert skifter forskernes fokus over til inflammasjonens potensielle betydning mens sviktende tyggeevne kommer mer i bakgrunnen. De svenske Betula-forskerne er også usikre på sine tidligere synspunkter og tør nå ikke lenger påstå at manglende tyggefunksjonen er utslagsgivende for kognitiv svikt (26).
Periodontitt og kognitiv svikt, epidemiologiske undersøkelser
En omfattende helseundersøkelse i USA inkluderte flere tusen pasienter der markører for oral sykdom som gingival blødning, periodontalt bentap og tanntap ble sammenholdt med resultater fra kognitive tester i flere aldersgrupper. Etter å ha korrigert for aktuelle kovarianter ble det påvist en sammenheng mellom alle tre markører og nedsatt kognitiv funksjon. For den yngste gruppen av pasienter gjaldt det resultater etter Symbol Digit Substitution Test (SDST) og Serial Digit Learning Test (SDLT), og for den eldre gruppen Story Recall Test (27). I fortsettelsen av denne undersøkelsen ble 2355 personer over 60 år testet for serum immunglobulin mot Porfyromonas gingivalis, som er en markør for periodontitt. Det viste seg at personer med høye IgG-verdier mot P. gingivalis viste dårligere prestasjoner på Delayed Verbal Recall Test og på subtraksjonstester (28).
Sparks Stein og medarbeidere fant også forhøyet antistoffkonsentrasjon mot periodontittmarkørene P. intermedia og F. nucleatum i serum både hos pasienter som hadde Alzheimers sykdom og hos personer som senere kom til å utvikle slik sykdom (29). En indisk undersøkelse kunne bekrefte sammenhengen mellom kliniske og serologiske periodontittmarkører og demens (30). Flere andre undersøkelser trekker i samme retning: Som del av en studie over risiko for aterosklerose hos eldre middeladrende personer fant Naorungroi og medarbeidere at tannløse personer og personer med få tenner og tydelig gingival blødning hadde lavere skår enn kontroller på kognitive prøver som Delayed Word Recall, Digit-Symbol Substitution (DSS) og Verbal Fluency Test. Tannløshet ble tolket som forårsaket av tidligere periodontitt, mens gingival blødning indikerte en pågående inflammasjon (31). I en prospektiv kohortstudie fra USA ble 1053 pasienter testet over en femårsperiode med Modified Mini-Mental State Examination Test og resultatene sammenholdt med resultatene etter en grundig periodontal undersøkelse foretatt i år to. Det viste seg å være en sammenheng mellom kognitiv svikt i årene tre til fem og de tidligere påviste periodontale indikatorene (32).
Inflammasjon og Alzheimer
Problematikken knyttet til periodontitt, tanntap og demens har vakt stor interesse fra forskere langt utenom odontologi, nærmere bestemt innen nevrologi, gerontologi, psykologi og psykiatri. Stikkordet her er inflammasjon. Velkjente indikatorer på inflammasjon er økning av CRP (C-reaktivt protein) og TNF-alfa (tumor nekrose faktor alfa, en inflammatorisk cytokin), i serum. Schmidt og medarbeidere (2002) hadde tilgang på data for CRP-nivået i serum hos japansk/amerikanske menn fra mange år tilbake og evaluerte så demens ved kliniske og nevropsykologiske tester. Det viste seg at menn med høyt CRP-nivå hadde øket risiko for alle typer demens, inkludert Alzheimers (33). Holmes og medarbeidere målte TNF-alfa hos pasienter i varierende stadier av Alzheimer og fant at kognitiv svekkelse ble forverret ved inflammasjonsepisoder (34). Mye tyder derfor på at en bakteriell infeksjon med tilhørende inflammasjonsreaksjoner kan ha betydning for utvikling av Alzheimers. Men hvilke mekanismer kan i så tilfelle kan være i aksjon?
Mekanismer ved en sammenheng mellom periodontitt og demens
Hypoteser om mekanismer for en sammenheng mellom periodontal infeksjon og demens er presentert i oversiktsartikler av flere forfattere (se figur 2). Watts og medarbeidere (2008) sammenlikner problemstillingen periodontitt/demens med hypoteser for utvikling av aterosklerose og kardiovaskulær sykdom, der kjerneprosessen er inflammasjon. Forfatterne viser til at endotoksin (LPS) fra Gram-negative bakterievegger kan indusere cytokinproduksjon, som i sin tur kan forandre blodkoagulasjonen og føre til aterosklerose og trombogenese. De hevder at periodontal infeksjon med inflammasjonsreaksjoner kan spille en liknende rolle ved utvikling av Alzheimers, idet bakterier fra supragingivalt plakk og subgingivale ulcerasjoner kan spres til blodsirkulasjonen etter å ha forsert svekkede fysiske, kjemiske og immunologiske barrierer. De påpeker at inflammasjonsmarkører i blod ved alvorlig periodontitt som CRP, IL-6 (interleukin 6) og TNF-alfa, alle er koplet til risiko for hjerneslag og koronar hjertesykdom og at post mortem-undersøkelser av Alzheimerpasienter har bekreftet en økning av de samme markørene i temporalkorteks. Samtidig finnes CRP og beta-amyloid i de ekstracellulære plakkene og de intracellulære tau-protein-aggregatene. Disse forfatterne antyder at inflammatoriske cytokiner kan komme inn i hjernevev ved spesifikke transportprosesser i blod/hjernebarrieren eller ved å omgå denne barrieren via kapillærer i de såkalte sirkumventrikulære organer. Enkelte ganger inneholder også hjernevevet antistoffer mot Gram negative bakterier, som kanskje kan ha nådd hjernen via trigeminusnerven. Inflammasjonsmarkørene opptrer først i blod, men det utelukkes ikke at inflammasjonsprosessen kan starte i hjernevev (35).
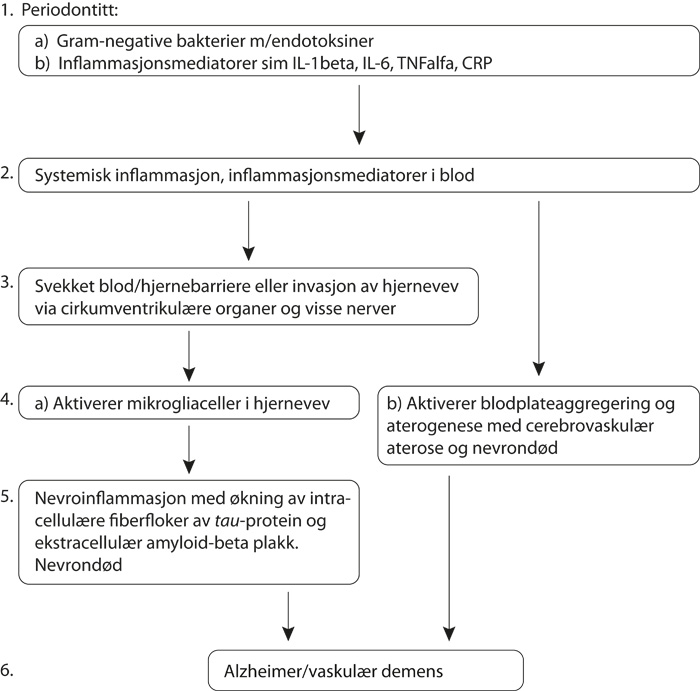
Figur 2. Assosiasjon mellom periodontal sykdom og demens.
I begge tilfelle blir hjernevevets mikrogiaceller aktivert. Disse cellene er sentralnervesystemets makrofager som bidrar til kronisk nevrodegenerativ sykdom ved å frigjøre inflammatoriske mediatorer som akuttfaseproteiner, komplementfaktorer, prostaglandiner, frie radikaler og cytokiner. Dette fører til aggregering av beta-amyloid og tau protein med nevrontap og ateromatøse, vaskulære forandringer (36). Etter denne hypotesen har mikrogliacellene en dobbelfunksjon, idet de både kan aktiveres til å ta seg av «inntrengere» og frigi toksiske substanser som kan føre til skade på det omgivende hjernevev (37).
Inflammasjonsteorien har fått støtte fra forskere som påpeker at proinflammatoriske cytokiner og CRP i plasma kan predikere Alzheimer så mye som 5 år på forhånd og minner om at Alzheimer forverres etter infeksjoner (38). De antyder at permeabiliteten i blod/hjernebarrieren kan økes ved lipoplysakkarid fra periodontale Gram-negative bakterier som finnes igjen i hjernevev hos Alzheimer-pasienter. Samme forskerteam setter opp modeller både for hvordan periodontale bakterier kan indusere patologiske reaksjoner langt fra utgangspunktet via aspirasjon, bakteriemi, endotoksemi etc. og for hvordan inflammatoriske molekyler påvirker mikrogliaceller til å produsere amyloid og tau-protein (39).
Også de seneste oversiktene omtaler felles risikofaktorer for cerebrovaskulær sykdom og Alzheimer der inflammasjonstrykket fra periodontitt kan spille inn (40). Det hevdes at langvarig eksponering for visse inflammasjonsmediatorer fra Gram negative og anaerobe bakterier med relasjon til periodontal infeksjon kan gjøre blod/hjernebarrieren svakere i tillegg til at slike bakterier kan følge nervebaner for N. trigeminus og N. olfactorius (41.)
Sluttbemerkninger
Den foreliggende oversikten viser hvordan nevrofysiologi og psykologi har gjort oral helse til tema i relasjon til kognitiv funksjon og utvikling av demens. De siterte forskningsrapporter og oversikter er valgt ut etter skjønn for å gi et bilde av aktuelle synspunkter, i alt vesentlig ved søk i Medline og i referanselisten til nyere oversikter. Tyggefunksjonens positive betydning for kognitiv funksjon har støtte i eksperimentelle data fra dyreforsøk. Også data fra tyggeforsøk hos mennesker kombinert med ikke-invaderende bildeteknikker av hjernefunksjonen, indikerer at tygging kan styrke kognitive funksjoner. Mange forskere har fulgt dette sporet i epidemiologiske undersøkelser av demens hos aldrende mennesker slik man kan avdekke det ved nevropsykologiske tester. En vanlig observasjon er at manglende tyggeevne som følge av tanntap er koplet til svekkete kognitive evner over tid. Samsvar i tid er imidlertid ikke tilstrekkelig for å hevde at manglende tyggeevne fører til kognitiv svikt idet mental svekkelse erfaringsmessig kan føre til hygienisk forfall og dermed tanntap.
Etter hvert har man sammenstillet epidemiologiske data om kognitiv svikt og tanntap mer med årsakene til tanntap, der periodontitt er en vesentlig faktor. Registrering av gingivitt og tap av alveolært ben er derfor kommet sterkere inn i resonnementene. Fokus for kognitiv funksjon og orale forhold har dermed skiftet over fra mastikasjonens rolle til den periodontale inflammasjonens potensielle betydning. Forskerne tar utgangspunkt i hypoteser for inflammasjonens betydning ved aterosklerose og utvikling av hjerte/karsykdom, som kan ha en parallell ved utvikling av vaskulær demens. De finner også argumenter for at utvikling av Alzheimer kan settes i relasjon til inflammasjonen. Det pekes her på at inflammasjonsmediatorer og visse gramnegative bakterier kan bane seg veg til hjernevev og sette i gang lokale inflammasjonsreaksjoner i hjernevev med opphopning av amyloide plakk som ender med destruerte nevroner. Det vanskeligste å forklare for forskerne og det vanskeligste å forstå for en observatør, er hvordan inflammasjonsmolekyler fra periodontitt kan forsere eller omgå blod/hjerne barrieren. Problematikken likner den som finnes ved å få medikamenter som for eksempel L-dopa på plass i hjernevev ved behandling av Parkinsons sykdom.
En nærliggende konklusjon på grunnlag av den siterte litteraturen på området er at oral sykdom med tanntap kan være en medvirkende årsak ved utvikling av demens. Det finnes argumenter for at manglende mastikasjon kan ha negativ betydning for den kognitive status, men de vitenskapelige argumentene for at en bakteriell sykdom som periodontitt kan være medvirkende, er nok tyngre. Under alle omstendigheter viser en rekke studier at oral helse henger sammen med kognitiv funksjon, selv om detaljene i dette samspillet ikke kan sies å være klarlagt.
Takk
Takk til Jan Tore Samuelsen for hjelp med figurene.
Noen kognitive tester
1. Auditory Verbal Learning Test og ( Delayed ) Verbal Recall Test går ut på å gjenta en bestemt rekke umiddelbart eller etter en viss tid.
2. Verbal Fluency Test. Si så mange ord som mulig av en bestemt kategori på en gitt tid. Testen kan være fonetisk (ord med en bestemt forbokstav) eller semantisk (ord for bestemte ting). COWAT (Controlled Oral Word Association Test) er en variant av den samme testen.
3. Story Recall Test. Gjenfortelle et sett av fortellinger uten å blande sammen.
4. Serial Subtraction Test. Trekke fra et tall (f.eks. 3) i serie fra et bestemt tallmessig utgangspunkt.
5. Serial Digit Learning Test (SDLT). Gjenta en tallrekke på 8 eller 9 urelaterte sifre.
6. Symbol Digit Substitution Test (SDST). Sammenholde 9 bestemte symboler med sitt riktige tall.
7. Spatial Memory Test. Tester evne til å huske omgivelser og bedømme romlige forhold, f.eks. trafikkbildet.
8. Stroop Colour Word Test. Beskrive plansjer med farger og ord og der tekst og farge ikke stemmer overens uten å la seg forvirre.
9. Mini Mental State Examination (MMSE). En test med 30 oppgaver som omfatter orientering i tid og sted, evne til å gjenta navn og setninger, sette navn på ting, stave ord baklengs og utføre praktiske oppgaver. En oppnådd poengsum på 27 - 30 er normalt. Kognitiv svekkelse bedømmes etter størrelsen på poengsummen.
Testene legger vekt på hukommelse og eksekutive egenskaper og brukes blant annet ved utredning av demens. Episodisk hukommelse er minnet om egen personlig historie, når, hvor, hvorfor. Semantisk hukommelse er generell faktakunnskap. Eksekutive funksjoner er evne til målrettet atferd, å kunne planlegge, organisere og styre sin virksomhet og å kunne adaptere seg til forandrete situasjoner.
English summary
Oral health and congitive function
Experiments using radial arm mazes show that mice and rats have difficulties finding food when their chewing capability is disturbed after molar extraction. Observations of this kind have indicated an association between mastication and cognition. Experimental evidence show increased blood stream and neuronal activity in young individuals using chewing gum. Some experiments also indicate that memory and other cognitive functions improve during chewing. Observations of this kind have led to the concept that inferior mastication also may have an impact on the development of age related dementia.
A series of epidemiological investigations confirm the association between loss of teeth and dementia, although the causation is uncertain. Some researchers propose that loss of masticatory stimulus may induce failures of neuronal activity. Others point to the fact that tooth loss is most often caused by a bacterial disease such as periodontitis, causing infectious agents and inflammatory host reactions to induce the microglia cells of brain tissue to reactions ending with neuronal death. At present, the inflammation hypothesis has the most credibility in neurological and psychological research. However, it is underlined that the association between oral disease and cognitive failure among older people does not necessarily indicate a causal relationship, because many circumstances related to dementia may cause poor oral health.
Jacobsen N. Oral helse og kognitiv funksjon. Nor Tannlegeforen Tid. 2016;126:344-9. doi:10.56373/2016-5-3
Referanser
Engerdal K, Haugen PK. Demens. Fakta og utfordringer. Forlaget Aldring og helse. 5. utgave 2009.
Solomon A, Kivipelto M, Winblad B. Alzheimers sjukdom och vaskulär demens. I Lars Olson m. fl. Hjärnan. Karolinska Institutet, University Press: 2007; 383 - 401.
Weijenberg RAF, Scherder EJA, Lobbzoo F. Mastication for the mind - the relationship between mastication and cognition in ageing and dementia. Neurosci Biobehav Rev. 2013; 35: 483 - 97.
Kato T, Usami T, Noda Y, Hasegawa M, Ueda M, Nabesima T. The effect of the loss of molar teeth on spatial memory and acetylcholine release from the parietal cortex in aged rats. Behav Brain Res. 1997; 83: 239 - 42.
Yamamoto T, Hiravama A. Effects of soft-diet feeding on synaptis density in the hippocampus and parietal cortex of senescence-accelerated mice. Brain Res. 2001; 902: 255 - 63.
Onozuka M, Watanabe K, Fujita M, Tonosaki K, Saito S. Evidence for involvement of glucocorticoid response in the hippocampal changes in aged molarless SAMP8 mice. Behav Brain Res. 2002; 131: 125 - 9.
Tsutui K, Kaku M, Motokawa M, Tohma Y et al. Influence of reduced masticatory sensory input from soft-diet feeding upon spatial memory/learning ability in mice. Biomed Res. 2007; 28: 1 - 7.
Ono Y, YamamotoT, Kubo KY, Onozuka M. Occlusion and brain function: mastication as a prevention of cognitive dysfunction. J Oral Rehabil. 2010; 37: 624-40.
Farella M, Bakke M, Michelotti A, Marotta G, Marina R. Cardiovascular responses in humans to experimental chewing of gums of different consistencies. Arch Oral Biol. 1999; 44: 835 - 42.
Onozuka M, Fujita M, Watanabe K, Hirano Y, Niwa M, Nishiyama K, Saito S. Age related changes in brain regional activity during chewing: a functional magnetic resonance imaging study. J Dent Res. 2003; 82: 657 - 60.
Wilkinson L. Sholey A, Wessnes K. Chewing gum selectively improves aspects of memory in healthy volunteers. Apetite. 2002; 38: 235 - 6.
Baker JR. Bezance JB, Zellaby E, Aggleton JP. Chewing gum can produce context-dependent effects upon memory. Appetite. 2004; 43: 207 - 10.
Hirano Y, Obata T, Kashikura K, Nonaka H, Tachibana A, Ikehira H, Onozuka M. Effects of chewing in working memory processing. Neurosci Lett, 2008; 465: 189 - 92.
Scherder E, Posthuma W, Bakker T, Vuijik PJ, Lobbezoo F. Functional status of masticatory system, executive function and episodic memory in older persons. J Oral Rehab. 2008; 35: 324 - 36.
Scholey A, Haskell C, Robertson B, Kennedy D, Milne A, Wetherell M. Chewing gum alleviates negative mood and reduces cortisol during acute laboratory psychological stress. Physiol Behav. 2009; 97: 303 - 12.
Johnson AJ, Jenks R, Miles C, Albert M, Cox M. Chewing gum moderates multi-task induced shifts in stress, mood, and alertness. A re-examination. Appetite. 2011; 56: 408 - 11.
Ohkubo C, Morokuma M, Yoneyma Y, Matsuda R, Lee JS. Inter-actions between occlusion and human brain function activities. J Oral Rehab. 2013; 40: 119 - 29.
Bergdahl M, Habib R, Bergdahl M, Nyberg L, Nilsson LG. Natural teeth and cognitive function in humans. Scand J Pyschol. 2007; 48: 557 - 65.
Hansson P, Sunnegårdh-Grönberg K, Bergdahl J, Bergdahl M, Nyberg L, Nilsson LG. Relationship between natural teeth and memory in a healthy elderly population. Eur J Oral Sci. 2013; 121: 333 - 40.
Lexomboon D, Trulsson M, Wårdh I, Parker J. Chewing ability and tooth loss: association with cognitive impairment in an elderly population study. J Am Geriatr Soc. 2012; 60: 1951 - 6.
Stein PS, Desrosiers M, Donegan SJ, Vepes JF, Kryscio RJ. Tooth loss, dementia and neuropathology in the Nun Study. J Amer Dent Ass. 2007; 138: 1314 - 22.
Stein PS, Kryscio RJ, Desrosiers M, Donegan SJ, Gibbs MG. Tooth loss, apolipoprotein E, and decline in delayed word recall. J Dent Res. 2010; 89: 471 - 7.
Okamoto N, Morikawa M, Okamoto K, Habu N, Iwamoto J, Tomioka K, Yanagi K, Saeki K, Yanangi M, Amano N, Kurumatani N. Relationship of tooth loss to mild memory impairment and cognitive impairment; findings from Fujiwara-kyo study. Behav Brain Funct. 2010; 6: 77 online.
Yamamoto T, Kondo K, Hirai H, Nakade M, Aida J, Hirata Y. Association between self-reported dental health status and onset of dementia: a 4-year prospective cohort study of older Japanese adults from Aichi Gerontological Evaluation Study (AGES) Project. Psychsom Med. 2012; 74: 241 - 8.
Kaye EK, Valencia A, Baba N, Spiro A 3rd, Dietrich T, Garcia RI. Tooth loss and periodontal disease predict poor cognitive function in older men. J Am Geriatr. 2010; 58: 713 - 8.
Hansson P, Bergdahl J, Bergdahl M, Nyberg L, Adolfson R, Nilsson L-G. Dental status is unrelated to the risk of dementia: A 20-year prospective study JAGS 2014; 62: 979 - 81.
Stewart R, Sabbah W, Tsakos G, D'Aiuto F, Watt RG. Oral health and cognitive function in the third national health and nutrition examination survey (NHANES-III) Psychosom Med. 2008; 70: 963 - 41.
Noble JM, Borrell LN, Papapanou PN, Elkind MS, Scarmeas N, Wright CB. Periodontitis is associated with cognitive impairment among older adults: analysis of NHANES-III. J Neurol Neurosurg Psychiatry. 2009; 80: 1206 - 11.
Sparks Stein P, Steffen MF, Smith C, Jicha G, Ebersole JL, Abner E, Dawson D 3rd. Serum antibodies to periodontal pathogens are a risk factor for Alzheimer's disease. Alzheimers Dement. 2012; 8: 196 - 203.
Rai B, Kaur J, Anand SC. Possible relationship between periodontitis and dementia in a North Indian old age population: a pilot study. Gerodontology. 2012; 29: 200 - 5.
Naorungroi S, Schoenbach VJ, Beck J, Mosley TH, Gottesman RF, Alonso A, heiss G, Slade GD et al. Cross-sectional associations of oral measures with cognitive function in late middle-aged adults: a community-based study. J Am Dent Assoc. 2013; 144: 1362 - 71.
Stewart R, Weyant RJ, Garcia ME, Harris T et al. Adverse oral health and cognitive decline: the health, aging and body composition study. J Am Geriatr Soc. 2013; 61: 177 - 84.
Schmidt R, Schmidt H, Curb JD, Masaki K, White LR Launer LJ. Early inflammation and dementia: a 25-year follow-up of the Honolulu-Asia Aging Study. Ann Neurol. 2002; 52: 168 - 74.
Holmes C, Cunningham C, Zotova E, Woolford J et al. Systemic inflammation and disease progression in Alzheimer disease. Neurology. 2009; 73: 768 - 74.
Watts A, Crimmins EM, Gatz M. Inflammation as a potential mediator for the assosiations between periodontal disease and Alzheimer's disease. Neuropsychiatr Dis Treat. 2008; 4: 865 - 76.
Perry VH. The influence of systemic inflammation on inflammation in the brain: implications for chronic neurodegenerative disease. Brain Behave Immuny. 2004; 18: 407 - 13.
Schwab C, McGeer PL. Inflammatory aspects of Alzheimer Disease and other neurodegenerative disorders. J Alzheimer's Dis. 2008; 13: 359 - 69.
Kamer AR, Dasanayake AP, Craig RG, Glodzik-Sobanska L et al. Alzheimer's disease and peripheral infections: The possible contribution from periodontal infections, model and hypothesis. J Alzheimer's Dis. 2008; 13: 427 - 49.
Kamer AR, Craig RG, Dasanayake AP, Brys M, Glodzik-Sobanska L, de Leon M. Inflammation and Alzheimers's disease: Possible role of periodontal diseases. Alzheimer's & Dementia. 2008; 4: 242 - 50.
Singhrao SK, Harding A, Simmons S, Robinsson S, Kesavalu L. Cream S. Oral inflammation, tooth loss, risk factors, and association with progression of Alzheimer's disease. J Alzheimer's Dis 2014. 42: 723 - 37.
Shoemark DK, Allen SJ. The microbiome and disease: Reviewing the links between the oral microbiome, aging and Alzheimer's disease. J Alzheimers Dis. 2014.DOI 10.3233/JAD -141170. (online).
Adresse: Nils Jacobsen, Nordisk institutt for odontologiske materialer (NIOM as), Sognsveien 70 A, N-0855 Oslo. E-post: n.j.jacobsen@niom.no
Artikkelen har gjennomgått ekstern faglig vurdering.
Jacobsen N. Oral helse og kognitiv funksjon. Nor Tannlegeforen Tid. 2016; 126: 344-9.
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Jacobsen N. Oral helse og kognitiv funksjon. Nor Tannlegeforen Tid. 2016;126:344-9. doi:10.56373/2016-5-3