Nils Jacobsen, Qalbi Khan og Arne Hensten
Drømmen om nye tenner
Professor emeritus, Nordisk Institutt for Odontologiske Materialer, NIOM, Oslo
Førsteamanuensis, Institutt for medisinsk biologi, Det helsevitenskapelige fakultet, UiT Norges arktiske universitet, Tromsø
Professor emeritus, Institutt for klinisk odontologi, Det helsevitenskapelige fakultet, UiT Norges arktiske universitet, Tromsø
Hovedbudskap
Tannleger har lenge vært opptatt av muligheten for å gjenskape et tredje sett av tenner.
Basalforskerne kjenner mange detaljer i tannutviklingen, men gjenskaping av humane tenner synes å være langt unna virkeligheten.
Regenerasjon av enkeltkomponenter kan være mulig.
Tannlegene vært opptatt av muligheten for å få dannet nye tenner lenge. Det har ført til et nøye studium av den embryonale tanndannelsen for å kunne kopiere den eksperimentelt. Forskningen har imidlertid bare i liten grad kunnet anvende sine eksperimentelle oppsett på mennesker, men har benyttet seg av dyr som mus, rotter, minigriser og hunder, enkelte ganger i kombinasjon med in vitro oppdyrking av bestemte celler. Med utgangspunkt i stamceller både fra tannrelatert vev eller fra fettvev og benmarg, har man kunnet få utviklet nytt pulpavev eller rothinne med cement og fibre. På mus har man også fått en helt ny tannkim til å utvikle seg ved å transplantere de relevante cellene til en tom sokkel. Detaljkunnskapen om rollen til celler og signalstoffer ved tanndannelse har økt betydelig gjennom de siste årene, men det er vanskelig å se at mulighetene for å utvikle nye humane tenner er kommet nærmere. Kanskje kan det ligge en viss gevinst i regenerasjon av pulpa og periodontalt vev.
Tanken om et tredje sett av tenner har fått en viss aktualitet etter at stamcelleforskningen har åpnet flere muligheter for vevsregenerasjon. Luukko og medarbeidere (2004) har publisert en oversikt over dette tema basert på forskning på mus. På mus går utviklingen av tenner rimelig raskt, men prinsippene er de samme som for mennesker, der tannutviklingen går over flere år (1). Mange forskere har grepet fast i dette tema med den bakenforliggende motivasjon å finne frem til metodikker som kan anvendes på mennesker. Det følgende er et forsøk på å gi forenklet bilde av aktuell forskning som tar sikte på å regenerere tenner og tannrelatert vev.
Embryonal tanndannelse
Tidlig i tannlegestudiet blir vi kjent med at tennene utvikles fra ektodermale og ektomesenkymale vevstyper med en basalmembran mellom. Det hele starter med at en epitelfortykkelse går over i plakodeform. En plakode er en lokal fortykkelse av embryologisk ektoderm som utvikler seg til bestemte strukturer (øre, linse, tenner etc.). Den dentale plakoden utvikler seg videre til en knoppform som i sin tur går over i hette- og klokkeform. Den siste blir forløperen til tannkronens endelige form slik man kan se den på histologiske snitt (2,3). Disse ektodermale strukturene danner blant annet «emaljeorganet», som har evne til å indusere underliggende ektomesenkymalt vev (dental papilla) til å utforme pulpavev og dentinproduserende odontoblaster. Samtidig utvikles ameloblaster fra emaljeorganets cellelag som ligger nærmest dental papilla.Når kronestrukturen er fullført, danner epitelvevet den Hertwigske rotskjede/rotepitel som avgrenser og «orkestrerer» utformingen av tannroten. I følge Balic og Thesleff (2015) er kommunikasjonen mellom epitelialt og mesenkymalt vev et prinsipp som gjelder utformingen av alle organer av kombinert epitelial og mesenkymal opprinnelse (4). Det er altså et samspill mellom de to embryologiske vevene som får dem til å utvikle og definere hverandre mot spesifikke typer grupper av morfogenetiske celler og strukturer. Denne dansen mellom vevene utføres med hjelp av molekylærbiologisk signalisering, hvor signalveiene Wnt, BMP, FGF, Hedgehog og EDA ser ut til å spille en særlig viktig rolle (tabell 1). Kunnskap om disse prosessene er kartlagt primært ved å studere tanndannelsen hos mus og rotter (4).
Eksperimentell tanndannelse
Forskere har forsøkt å kopiere tannutviklingen ved å ta i bruk ny kunnskap innen stamcelleforskning og bioteknologi. Stamceller er primitive celler med bredt differensieringspotensiale. Dentale stamceller har sin opprinnelse i vev som pulpa, rothinne, apikalpapillen hos ikke ferdigdannede tenner og fra bindevevet rundt tannkimen (follikkelen). Epiteliale og ektomesenkymale stamceller fra tannkimen hos mus har, sammen med de riktige «scaffolds» (stillasmaterialer), kunnet initiere tannutvikling in vitro. Ifølge Oshima og medarbeidere (2011) kunne slike in vitro kulturer utvikle seg til molarer som så kunne transplanteres til alveolen for en ekstrahert molar (5).
Stillasmaterialene er biomaterialer som bestemmer vevsstrukturen og kan eventuelt resorberes når veksten er fullført (6). Det settes store krav til slike materialer når det gjelder biokompatibilitet, porøsitet, mekaniske egenskaper og degraderingsevne. Stillasene består derfor av biomaterialer som i form og struktur etterlikner det vevet stamcellene skal vokse inn i. Det er kan være tale om organiske materialer som kollagen eller alginat eller syntetiske materialer som keramikk eller polymer. Porøse materialer gir muligheter for tredimensjonal cellevekst (7). Flere forskere har påpekt vanskelighetene med denne teknikken med hensyn til å utvikle nye tenner hos mennesker (8), mens andre har sett mer optimistisk på muligheten til å få et tredje sett av tenner til å vokse ved en kombinasjon av stamceller og biomaterialer (9). I 2019 ble det publisert en nøyaktig oppskrift på hvordan man kan produsere tannanlegg ved å dyrke humane celler under huden på rotter og griser ved å bruke gelatin metakrylat som stillas («scaffold») (10).
Wnts – Forkortelse av flere ord: |
Signalproteiner ved utviklingsprosesser. |
BMP – Bone morphogenetic protein: |
Morfogenetisk signalprotein for hårdvev. |
FGF – Fibroblast growth factor: |
Generell morfogenetisk signalprotein. |
Hedgehog- Generelt i naturen: |
Signalprotein ved celledifferensiering. |
EDA – Ectodysplasin: |
Signalprotein for tenner, hår, kjertler etc. |
Regenerasjon av tannrelatert vev
Regenerasjon av tannrelatert vev med egne celler ligger nærmere de kliniske muligheter. En slik tilnærmelse for å restaurere et skadet organ eller skadet vev tilhører fagområdet «regenerativ medisin», som omfatter reparasjon av bestemte organdeler ved egne stamceller eller andre celletyper, eksempelvis for å reparere traumeskader, hudskader, kardiovaskulære sykdommer og cancer i tilfeller der organdonasjon ikke er aktuelt. Kjente eksempler er kondrocytter for å reparere skadet leddbrusk eller fibroblaster fra forhud for hudtransplantasjon (11).
Innen odontologien kan det være tale om regenerasjon av pulpavev, dentin og periodontale vevstyper som rothinne og cement. Utgangspunktet er ikke bare dentalt relaterte stamceller. Ifølge Hu og medarbeidere (2018) kan stamceller fra fettvev og benmarg brukes. I tillegg har bioteknologisk forskning avklart at voksne humane celler av forskjellig slag kan utvikles til såkalte pluripotente stamceller, som kan programmeres til å bli celler av hvilken som helst ønsket vevstype. Kunnskap om dette er ervervet både ved vevskultur, dyreforsøk og kliniske forsøk, det siste ofte med hensikten å regenerere pulpavev eller skape nytt feste i dype periodontale lommer (6).
Pulparegenerasjon
Hvor står man så med hensyn til å få tannvev til å regenerere hos mennesker? Et meget tidlig forsøk på dette området ble utført av Hørsted og Nygård-Østby (1978). De undersøkte våre egne cellers evne til å reparere pulpavev etter pulpotomi. Etter 6 måneder viste histologi innvekst av et cellerikt, fibrøst bindevev, ispedd dentinpartikler som etter hvert gikk over til et godt vaskularisert bindevev. Det hele ble tolket som reparasjon (12). Omtrent 40 år etter gjorde japanske forskere en pilotstudie for å få humant pulpavev til å vokse etter pulpotomi ved å anvende nedfryste stamceller høstet fra pasientenes egne, ekstraherte visdomstenner. Stamcellene ble oppdyrket i medium som inneholdt eget blodserum og vekstfaktor G-CSF (granulocytt kolonistimulerende faktor). Elektrisk pulpatesting, MRI-data og andre undersøkelsesteknikker viste tegn på innervering og vaskularisering, noe som ble tolket som tegn på pulparegenerasjon. Forfatterne skriver imidlertid at det er langt igjen til dette kan bli en praktisk virkelighet i klinikken (13). Videre på dette området har kinesiske forskere transplantert stamceller fra pulpa på egne melketenner til traumatiserte tenner hos 26 unge pasienter og har observert tydelige tegn på fornyet blodomløp og nervefunksjon (14).
Eramo og medarbeidere (2018) har sammenfattet eksperimenter både på dyr og mennesker der det er anvendt forskjellige metodikker for å få multipotente stamceller i blod fra området rundt rotspissen til å fylle opp en omhyggelig renset apikal del av pulpahulen. Blodkoagelet blir supplert med bioaktive vekstfaktorer og fungerer som «scaffold» for utvikling av fungerende pulpavev. En annen metode er å hente potensielle stamceller fra pulpa på egne ekstraherte visdomstenner, dyrke dem opp in vitro og transplantere dem til pulpahulen. I alle tilfeller er det snakk om kompliserte fremgangsmåter som er interessante innen forskning, men lite egnet i klinikken (15).
Hameed og medarbeidere (2019) har sammenfattet 15 kliniske forsøk etter århundreskiftet på å regenerere nekrotisk pulpavev på ikke ferdigdannede humane tenner ved å rense rotkanalen og la apikaldelen fylles med blod som grunnlag for nytt pulpavev. Det er påvist både økt dentintykkelse og fortsatt rotutvikling, inklusiv avslutning, men forfatterne er usikre på de egentlige histologiske og molekylære prosessene rundt deres funn (16).
Regenerasjon av periodontalt vev
Ifølge Yoshida og medarbeidere (2012) kan stamceller fra egen rothinne og periost øke regenerasjon av periodontalt vev som ben, sement og rothinne hos dyr som minigris og hund. Det nevnes også om forskere som fikk godkjent bruk av egne, oppdyrkede periosteale celler sammen med plasma og hydroksyapatitt for regenerasjon av periodontalt vev hos periodontalpasienter (17). Noen år senere publiserte franske forskere en eksperimentell, bakterieindusert periodontittmodell på mus der vevsnedbrytningen kom i stand etter introduksjon av periodontale patogener på bestemte molarområder. Deretter ble egne ektomesenkymale stromaceller fra fettvev transplantert til det aktuelle området, som senere ble undersøkt med histologiske og biokjemiske metoder. Det viste seg at cement og nye rothinnefibre, men ikke alveolært ben, hadde vokst frem der stromacellene ble transplantert. Det hele ble tolket som at stromaceller fra fettvev har potensiale for regenerasjon av periodontalt vev (18).
Det er også utført eksperimentelle undersøkelser der egne ektomesenkymale stromaceller fra munnhulen eller fra fettvev blir transplantert til periodontale defekter indusert med bor eller ligaturer på dyr som hunder og griser. Der ble det også observert regenerasjon av periodontalt vev som ben og cement. Forskerne er imidlertid forholdene når det gjelder anvendelse på mennesker (19).
Det foreligger da heller ikke alt for mange rapporter om human regenerasjon av periodontalt vev. En 10 år gammel rapport fra Taiwan belyser imidlertid problemstillingen: 3 mannlige periodontalpasienter mellom 25 og 42 år fikk ekstrahert 6 visdomstenner for å høste progenitorceller fra rothinnen. Cellene ble dyrket opp in vitro og deretter transplantert til benlommene på til sammen 16 tenner med periodontitt etter utført kirurgisk behandling. Etter opp til 72 måneders observasjonstid ble det målt betydelige forbedringen med vanlige periodontale målemetoder. Alle forbedringer ble tilskrevet celletransplantasjonen. Forskerne hadde alle tillatelser i orden og mener metodikken er trygg ettersom de anvender pasientens egne celler. De mener imidlertid at metodikken er for komplisert til å kunne anvendes i klinikken (20).
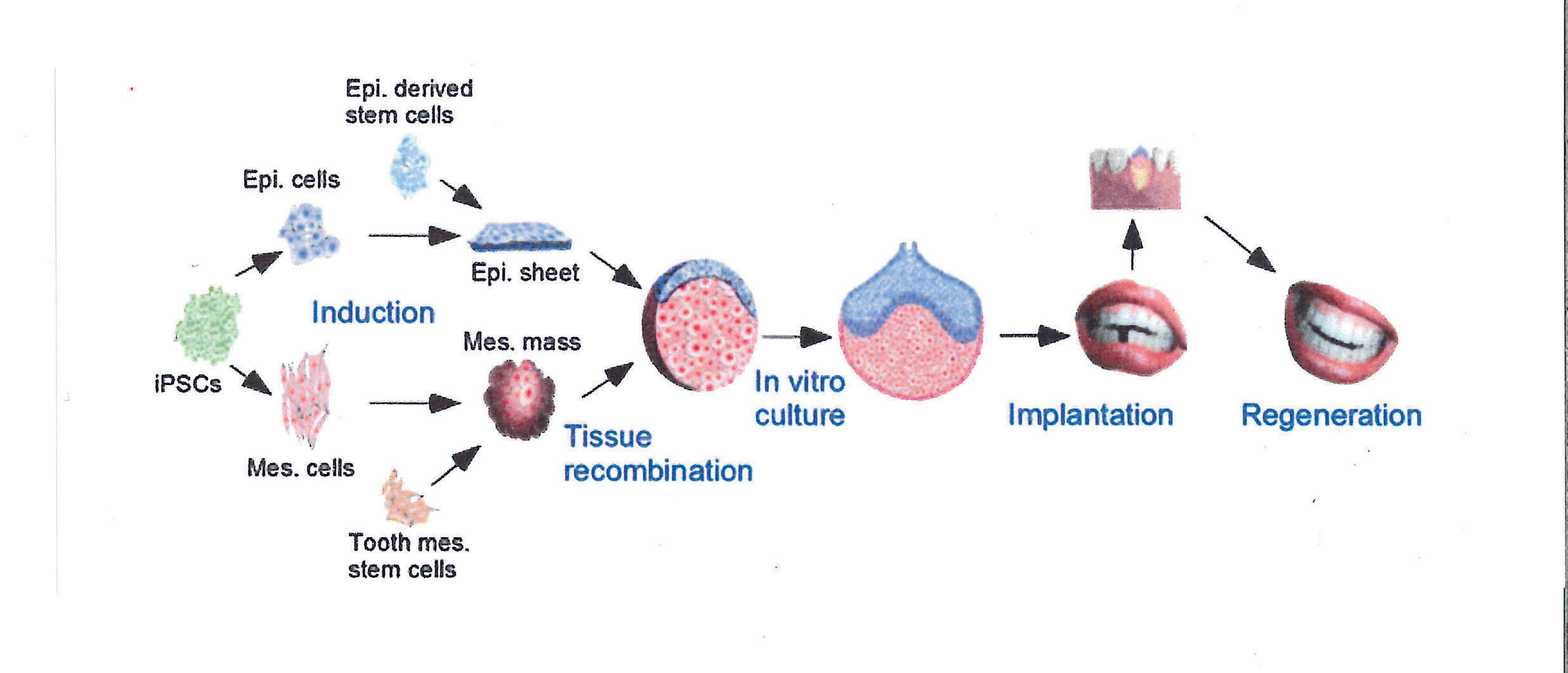
Figur 1. En skjematisk fremstilling av regenerasjon av hel tann gjennom rekombinasjon (Tissue recombination) av epitelvev (Epi.sheet) og mesenkymalt vev (Mes. mass), uten bruk av stillasematerialer. Disse vevene skal kunne fremstilles fra deres aktuelle stamcellenisjer, eller gjennom reprogrammeringsteknikker relatert til induserte pluripotente stamceller (iPSCs). In vitro-rekombinasjon av disse vevene vil kunne tillate utvikling til knopp- eller hettestadiet, før en overføring til tannalveolen for å erstatte tapt tann. Modifisert etter Zhang & Chen (25).
Diskusjon
Den siterte forskningslitteraturen er smakebiter av et stort kompleks av grunnforskning innen temaet regenerasjon av tenner og tannrelatert vev. Det foreligger særlig mange rapporter over regenerasjon av slike vevstyper vev på dyr, spesielt etter at man fikk større kunnskap og erfaring med stamceller. Noen av forskningsrapportene er også innom å kunne skape hele tannkimer som kan vokse videre til tenner. Det forekommer også enkelte rapporter som gjelder slike forsøk med humane tenner. Enkeltrapporter på dette området konkluderer ofte i en optimistisk tone med hensyn til fremtidig klinisk betydning, mens metaanalyser på samme området er mer forbeholdne. En samlet vurdering av manipulering av stamceller og signalstoffer til å kunne resultere i et organ som en human tann, beskrives blant annet av kinesiske forskere (21), men den kliniske anvendelsen virker ikke rundt hjørnet, selv om nytten av å kunne nydanne tenner er utvilsom for eksempel for barn med multiple agenesier. Den årelange tidsforskjellen for å gro tannvev hos menneske i forhold til smådyr som mus, trekkes ofte frem som en hindring, selv om alle andre faktorer skulle klaffe. Det advares også mot bruk av vekststimulerende molekyler for å øke veksthastigheten, da det kan ha uønskede bivirkninger (22).
Det synes derfor som at den økte detaljkunnskapen om kompliseringsgraden ved tanndannelse gjennom de siste årene, har fått mange fremstående forskere til å se målet om nydannede tenner fjerne seg. Thesleff (2018) påpeker således at de forskningsmessige muligheter ikke står i forhold til den kliniske virkeligheten hverken ved programmeringen av stamceller til dentale celler eller ved tidsaspektet (23).
Da er det mer realistisk å kunne regenerere enkelte dentale vevstyper, eksempelvis celler og vev til erstatning av skadede strukturer i pulpa-dentin komplekset, der det er observert øket dentintykkelse og rotvekst (16). Også ved pulpitt er det gjort observasjoner som tyder på at regenerasjon av fungerende pulpavev er mulig (24). Videre ser det ut til at det ligger innenfor mulighetene å regenerere periodontalt vev som rothinne og cement.
Zhang og Chen (25) har publisert en interessant planskisse for veien videre mot regenerasjon av nye tenner (figur 1).
I overskuelig fremtid er det imidlertid realistisk å mene at endodontisk behandling og fyllingsterapi vil være den praktisk/kliniske løsningen på tannproblemer sammen med tradisjonell periodontalterapi, som inneholder elementer av regenerasjon. Og fortsatt vil nok implantater og broer være løsningen for tapte tenner.
Referanser
Luukko K, Kvinnsland I H, Kettunen P. Framstilling av tenner ved hjelp av stamceller – en nyvinning for klinisk odontologi i fremtiden? Nor Tannlegeforen Tid. 2004; 114: 872–4.
Jussila M. and Thesleff I. Signaling networks regulating tooth organogenesis and regeneration, and the specification of dental mesenchymal and epithelial cell linages. Cold Spring Harb Perspect Biol. 2012; 4: 008425
Hovorakova M, Lesot H, Peterka M, Peterkova R. Early development of the human dentition revisited. J Anat. 2018; 233: 135–45.
Balic A, Thesleff I. Tissue interactions regulating tooth development and renewal. Curr Top Dev Biol. 2015; 115: 157–86.
Oshima M & al. Functional tooth regeneration using a bioemgineered tooth unit as a mature organ replacement regenerative therapy. PLoS. 2011; 6(7): e21531.doi: 10.1371/journal.pone.0021531
Hu L, Liu Y, Wang S. Stem cell-based tooth and periodontal regeneration. Oral Dis. 2018; 24: 696–705.
O’Brien Fergal J. Biomaterials & Scaffolds for tissue engineering. Materials Today. 2011; Vol 14, No 3, 88–95.
Zhang L, Morsi Y, Wang Y, Li Y, Ramakrishna S. Review scaffold design and stem cells for tooth regeneration. Japanese Dental Science Review. 2013; 49: 14–26.
Dadu SS, Tooth regeneration: Current status. Indian J Dent Res. 2009; 20: 506–507.
Smith EE, Yelick PC. Bioengineering tooth bud constructs using gelMA hydrogel. Methods Mol Biol. 2019; 1922: 139–150.
Mao AS, Mooney DJ. Regenerative medicine: Current therapies and future directions. Proc Natl Acad Sci USA. 2015; 112 (47): 14452–9.
Hørsted P, Nygaard-Østby B. Tissue formation in the root canal after total pulpectomi and partial root filling. Oral Surg Oral Med Oral Pathol. 1978; 46: 275–82.
Nakashima M, Iohara K, Murakami M, Nakamura H, Sato Y, Ariji Y, Matsushita K. Pulp regeneration by transplantation of dental pulp stem cells in pulpitis: a pilot study. Stem Cell Res Ther. 2017; 8(1): 61. Doi: 10.1186/s13287–017–0506–5
Xuan K, Li B, Guo H & al. Deciduus autologous tooth stem cells regenerate dental pulp after implantation into injured teeth. Sci Transl Med. 2018; 10, eaaf3227. doi: 10.1126/scitransimed.aaf3227
Eramo S, Natal A, Pinna R, Milla E. Dental pulp regeneration via cell homing. In Endodod J. 2018; 51: 405–419.
Hameed MH, Gul M, Ghafoor R, Badar SB. Managegement of immature necrotic permanent teeth with regenerative endodontic procedures – a review of literature. J Pak Med Assoc. 2019; 69: 1514–20.
Yoshida T, Washio K, Iwata T, Okano T, Ishikawa I. Current status and future development of cell transplantation therapy for periodontal tissue regeneration. Int J Dent. 2012; 307024. Doi: 10.1155/2012/307024.
Lemaitre M, Monsarrat P, Blasco-Baque V, Loubieres P, Burcelin R, Casteilla L, Planat-Benard V, Kemoun P. Periodontal tissue regeneration using syngeneic adopose-derived stromal celles in a mouse model. Stem Cells Trans Med. 2017; 6: 656–665.
Monserrat P, Vergnes JN, Nabet C, Sixou M, Snead ML, Planat-Benard V. Casteilla L, Kemoun P. Concise review: mesenchymal stromal cells used for periodontal regeneration: a systematic review. Stem Cells Transl Med. 2014: 3: 766–74.
Feng F, Akyiama K, Liu Y, Yamaza T, Wang T-M. Chen J-H, Wang B-B, Huang GT-J, Wang S, Shi S. Utility of PDL progenitors for in vivo tissue regeneration: A report of 3 cases. Oral Dis. 2010; 16: 20–28.
Zhai Q, Dong Z, Wang W, Li B, Jin Y, Dental stem cell and dental tissue regeration. Front Med. 2019; 13: 152–159.
Li L, Tang Q, Wang A, Chen Y: Regrowing a tooth: in vitro and in vivo approaches. Curr Opin Cell Biol. 2019; 61: 126–131.
Thesleff I. From understanding tooth development to bioengineering of teeth. Eur J Oral Sci. 2018; 126 Suppl 1: 67–71. doi: 10.1111/eos.12421.
Nakashima M, Iohara K, Murakami M, Nakamura H, Sato Y, Ariji Y, Matsushita K. Pulp regereration by transplantation of dental pulp stem cells in pulpitis: a pilot clinical study Stem Cell Res Ther. 2017; doi: 10.11867S13287–017–0506–5
Zhang Y, Chen Y. Bioengineering of a human whole tooth: progress and challenge. Cell Regeneration. 2014 3: 8
English summary
Jacobsen N, Khan Q, Hensten A.
The dream of new teeth
Nor Tannlegeforen Tid. 2021; 131: 270–4
The dental community has for a long time been fascinated by the thought of growing a third set of teeth. This has increased research interest in the processes of embryonal development of teeth for experimental copying. However, research of this kind cannot be performed on humans for medical and ethical reasons.
The researchers have used animals such as mice, rats, minipigs, dogs etc., sometimes in combination with in vitro cultivation of cell populations containing stem cells. With stem cells from different locations, pulp tissue and periodontal tissues such as cement and fibers have been developed. In mice, whole tooth germs could be grown after transplanting the relevant cells to an empty socket.
On the basis of the research reports cited here it is difficult to see that the possibilities of developing new human teeth are better than before the stem cell revolution, although there might be a clinical gain in the techniques for regeneration of pulpal and periodontal tissues.
Korresponderende forfatter: : Qalbi Khan, e-post: qalbi.khan@uit.no
Akseptert for publisering 12.02.2021
Artikkelen har gjennomgått ekstern faglig vurdering.
Jacobsen NJ, Khan Q, Hensten A. Drømmen om nye tenner. Nor Tannlegeforen Tid. 2021;131, 270–4
MeSH søkeord på norsk Tannutvikling, embryologi, regenerativ medisin, stamceller: