Endodontisk behandling av kalsifiserte tenner
Hovedbudskap
Rotkanalsystemet kan beskrives som uaffisert, partielt kalsifisert eller totalt kalsifisert.
Mekanismer bak kalsifisering i rotkanalsystemet kan deles inn etter lokale eller systemiske faktorer.
Celler med opphav i pulpa eller periodontalt vev kan gi ulike kalsifiseringsmønster i pulpa.
Endodontisk behandling av kalsifiserte rotkanalsystem er forbundet med lengre behandlingstid, økt tap av tannsubstans, og hyppigere prosedyreavvik.
Endodontisk behandling skal ikke utføres før det foreligger kliniske og røntgenologiske tegn på sykdom i pulpa og/eller periapikale vev.
Kalsifiseringer i rotkanalsystemet er utbredt og vil normalt tilta med økende alder. Basert på 2D- eller 3D-røntgen kan kalsifiseringsgrad og mønster beskrives som uaffisert, partielt eller totalt kalsifisert. De etiologiske faktorene knyttet til kalsifiseringer i rotkanalsystemet kan deles inn i lokale eller systemiske. Disse faktorene vil være avgjørende for kalsifiseringsgrad, og mønster, samt mulighet for å lokalisere en rotkanal i tannen. Sensibilitetstesting av tenner med kalsifiserte rotkanalsystem kan gi upålitelig resultat. Endodontisk behandling skal ikke utføres før det foreligger kliniske og røntgenologiske tegn på sykdom i pulpa og/eller periapikale vev. Endodontisk behandling av kalsifiserte rotkanalsystem er tidkrevende og forbundet med økt risiko for prosedyreavvik. Særlig kavumpreparering og kanalsøk er forbundet med risiko for tap av tannsubstans. Bruk av mikroskop vil være nødvendig ved kanalsøk. En avveiing mellom risiko og nytte bør være obligatorisk ved behandling av tenner med kalsifiserte rotkanalsystem.
Kalsifiseringer i rotkanalsystemet er relativt vanlig og er forbundet med tanntraumer, aldersrelaterte avsetninger av sekundær- og/eller tertiærdentin, og enkelte systemiske tilstander [1]. Kalsifiseringer i rotkanalsystemet er beskrevet som «pulpakanal kalsifisering», «pulpakanal obliterering» eller «kalsifiserende metamorfose», og betegner en situasjon hvor det skjer en normal [2] eller unormal kalsifisering eller avsetning av hardvev i rotkanalsystemet [3] [4].
Avhengig av kalsifiseringsgrad og mønster, vil endodontisk behandling innebære moderat til høy vanskelighetsgrad basert på American Association of Endodontists (AAE) sitt klassifikasjonssystem «Endodontic Case Difficulty Assessment Form» [5]. Kalsifisering av rotkanalsystemet vil maskere viktige anatomiske strukturer ved endodontisk kavumpreparering og etterfølgende kanalsøk [6]. Endodontisk behandling av kalsifiserte rotkanalsystem er derfor tidkrevende og forbundet med høy risiko for prosedyreavvik [7]. Kalsifiserte rotkanalsystem må betraktes som en preoperativ risikofaktor som bør vurderes og planlegges nøye før oppstart av endodontisk behandling.
Målet med denne oversiktsartikkelen er å belyse utbredelse, årsaker, klassifisering og endodontisk håndtering av kalsifiserte rotkanalsystem. Dette er del 1 av to artikler, hvor del 2 vil ta for seg CBCT (cone-beam computed tomography)-ledet tilkomstpreparering.
Epidemiologi
Eldres generelle og orale helse er blitt bedre, noe som har ført til at eldre beholder egne tenner lengre [8] [9]. Generelt er eldre tannsett preget av omfattende restorativ behandling og slitasje [2]. Derfor kan vi anta at dagens eldre har en økt forekomst av kalsifiserte rotkanalsystem grunnet avsetting av sekundær- og/eller tertiærdentin. Avsetning av tertiært dentin er en normal respons på karies og restorativ behandling, samtidig som grad av kalsifisering er en sum av tannens tidligere historikk [10].
Tanntraumer forekommer hyppig i overkjevens anteriore tenner, særlig blant unge individer [11] [12] [13] [14] [15]. Forekomsten av kalsifiserte rotkanalsystem etter traume er rapportert å ligge mellom 2,8 og 24 % i ulike studier [11] [12] [13] [14] [15]. Forekomsten av kalsifiserte rotkanalsystem er også avhengig av observasjonstid, alvorligheten av tanntraumet (type skade) og tannens rotutviklingsstadium [16]. Pulpanekrose oppstår hyppigere i tenner med fullstendig rotutvikling [17], mens kalsifiseringer i rotkanalsystemet sees hyppigere i tenner med ufullstendig rotutvikling [18].
Tenner med kalsifiserte rotkanalsystem etter tanntraumer kan over tid gå i nekrose med utvikling av apikal periodontitt (sekundær nekrose). Studier med 16 års gjennomsnittlig oppfølgingstid har rapportert en forekomst av sekundær nekrose på mellom 9 og 16 % [19] [20] [21]. Utvikling av apikal patologi er i tillegg korrelert med skadetype og rotutvikling [23]. En annen studie med oppfølgingstid på 4 år rapporterte sekundær nekrose i 7 % av tilfellene [11]. Generelt kan vi derfor anta at forekomsten av patologiske forandringer i pulpa og tilgrensende vev er avhengig av observasjonsperioden. En studie har rapportert en forekomst på hele 27 % [22], men denne studien avviker fra de andre ved at den kun fulgte en selektert gruppe tenner som var diagnostisert med partielt eller totalt kalsifisert rotkanalsystem. Oppfølging av tennene ble dermed startet på et senere tidspunkt enn selve tanntraumet.
Etiologi
De biologiske mekanismene bak kalsifiseringer i rotkanalsystemet er delvis forstått. I litteraturen finnes ulike teorier knyttet til faktorer som kan føre til kalsifisering av rotkanalsystemet. Disse faktorene kan deles inn etter lokale og systemiske faktorer.
Lokale faktorer
Dannelse av sekudærdentin er ansett som en fysiologisk prosess [23] [24]. Dannelse av tertiærdentin er derimot et resultat av eksterne stimuli og inflammasjon i pulpa [23] [24] [25].
Tertiærdentin dannes som en beskyttelse eller respons i en begrenset del av pulpa som korresponderer til området som blir utsatt for eksterne stimuli [26] (figur 1). Tilstedeværelse av bakterielle, termiske eller kjemisk irritamenter, uttørking av tannsubstans, samt mekanisk skade og slitasje kan stimulere til dannelse av tertiærdentin [24] [25] [27] [28] [29]. Det er identifisert to typer tertiærdentindannelse, reaksjonær og reparativ dentinogenese. Reaksjonær dentinogenese er observert i tilfeller hvor odontoblastene overlever de eksterne stimuli, med økt dentinavsetning som resultat (også betegnet som irritasjonsdentin). Reparativ dentinogenese er observert i mer alvorlige tilfeller hvor odontoblastene skades og erstattes av odontoblastlignende celler som differensieres fra mesenkymale stamceller i pulpa [24] [30] [31] [32].
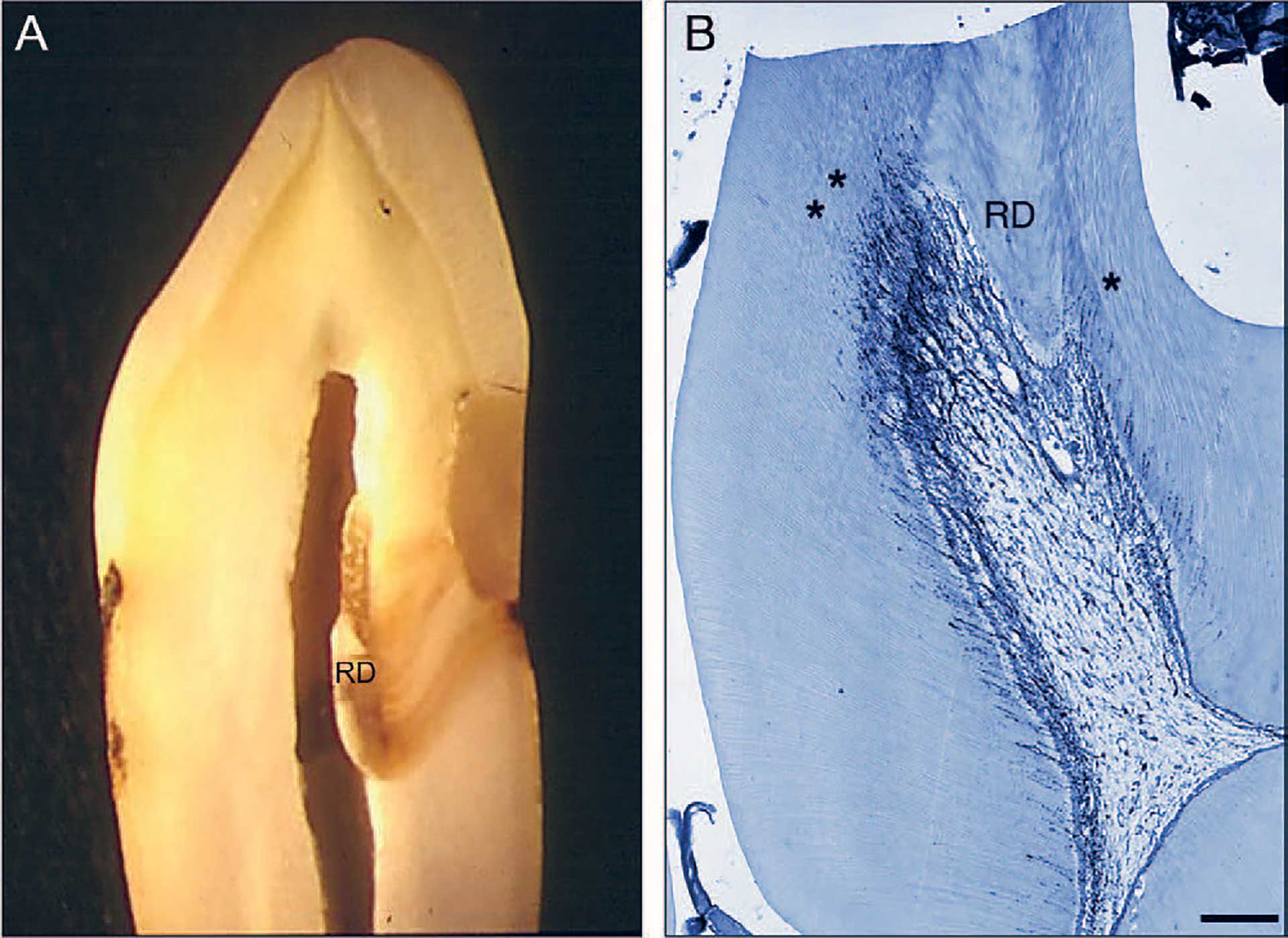
Figur 1 A. Histologiske snitt av human tann som viser avsetning av reparativt dentin (RD) i tilknytning til en fylling med lekkasje i nedre kant. B. Histologisk snitt fra en rottetann hvor det er avsetninger av reparativt dentin (RD) i tilknytning til attrisjon. Legg merke til hvordan reparativt dentin blokkerer for nervefibre som normalt forsyner dentintubuli* i de indre deler av dentin. (Bilde B med tillatelse fra Margaret Byers).
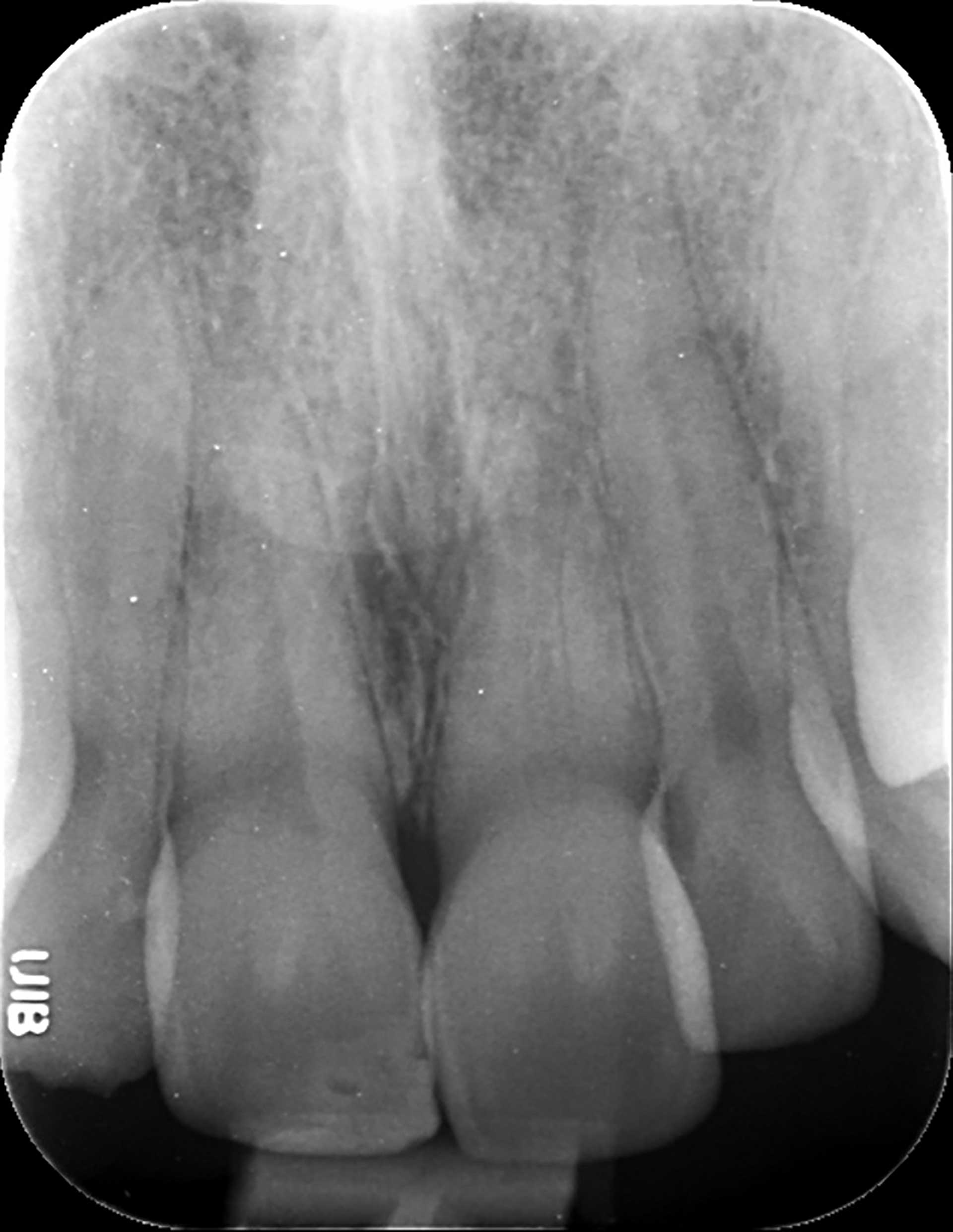
Figur 2. Tidlig tanntraume på en rotåpen tann 21 hvor det har skjedd innvekst av periodontalt vev med dannelse av periodontalligament mellom bein og indre tannvegg.
Mekanismene bak kalsifisering av rotkanalsystemet etter et tanntraume er omdiskutert. Et sentralt element i eksisterende teorier er skade på tannens neurovaskulære forsyning [33] [34]. En forklaring er at økt hardvevsavsetning skyldes stimulering av eksisterende odontoblaster eller tap av deres regulatoriske mekanismer [35]. Andre knytter fenomenet til skade og den påfølgende tilheling av pulpa. Celler i pulpa kan tape den autonome regulatoriske kontrollen ved alvorlig skade, som igjen fører til økt uorganisert hardvevsavsetning i pulpa under tilhelingsfasen [36]. En studie har vist at odontoblaster uttrykker reseptorer for neuropeptider, noe som tyder på at odontoblastaktiviteten delvis kan være styrt av perifere afferente nervefibre [37]. Ut ifra skadeomfanget er det sett ulike kalsifiseringsmønster. Ved større skade vil progenitorcellene som styrer tilhelingen kunne være av periodontalt opphav, med innvekst av periodontalt vev, og i sjeldne tilfeller med dannelse av et innvendig periodontalligament som resultat (figur 2). Dette er særlig aktuelt for umodne rotåpne permanente tenner. Det samme er også observert for autotransplanterte tenner hvor transplantasjon skal skje før roten lukkes [38] [39].
Kjeveortopedisk behandling kan påvirke pulpa sin nerve- og karforsyning [40] [41] [42] [43] [44]. Særlig aksiale krefter er vist å kunne ha en ugunstig effekt på blodsirkulasjonen i pulpa og i apikalområdet [45] [46]. Tenner med et kalsifisert rotkanalsystem etter tidligere tanntraume er rapportert å ha høyere forekomst av pulpakomplikasjoner når de utsettes for kjeveortopediske krefter [47]. Den samme studien viste også en positiv korrelasjon mellom pulpakomplikasjoner og grad av kalsifisering. Spekulasjoner om at kjeveortopedisk behandling kan framprovosere kalsifisering av rotkanalsystemet på friske tenner uten tidligere tanntraume er blitt lansert, men dette er kun basert på kasuistikker [48]. Det er så langt uenighet om hvorvidt det er en årsakssammenheng mellom kjeveortopedisk behandling og kalsifiseringer i rotkanalsystem på friske tenner [49] [50] [51] [52].
Systemiske faktorer
Mekanismene som ligger bak de ulike systemiske faktorene som antas å påvirke kalsifisering av rotkanalsystem vil variere. Generelt er det antatt at ubalanse av metabolitter og genetisk styrte regulatoriske mekanismer er en del av forklaringen. Dentinogenesis imperfekta (DI) og dentin dysplasi (DD) er her beskrevet som eksempler.
DI er en genetisk anomali som hovedsakelig påvirker dentin. Tidlig i tannutviklingen vil affiserte tenner ha et stort pulpakavum, men etter relativt kort tid er pulpakavum totalt kalsifisert. Tre varianter av DI er identifisert [53]. Type I er forårsaket av en mutasjon på ett av to gener som er involvert i kollagen I-syntesen. Type I er i tillegg forbundet med osteogenesis imperfekta (OI). Type II og III er derimot forbundet med mutasjoner i genet som koder for dentin sialofosfoprotein (DSPP). Dette genet finner man i nær relasjon til fire andre gen på kromosom 4 som er involvert i bein og/eller dentindannelse [54].
DD er en genetisk arvelig autosomal-dominant anormalitet. To typer, radikulær (type I) og koronal (type II), er beskrevet [53]. Ved radikulær DD er rotkanalsystemet total kalsifisert allerede før tannerupsjon. Ved koronal DD vil rotkanalsystemet bli kalsifisert kort tid etter erupsjon [53] [54] [55].
En rekke systemiske faktorer er identifisert i forbindelse med kalsifisering av rotkanalsystemet. Tilfellene er stort sett rapportert basert på kasuistikker, noe som gir usikkerhet rundt årsakssammenheng. Forskjellige systemisk tilstander og syndromer som er assosiert med ulike kalsifiseringsmønster er presentert i tabell 1.
Systemisk faktor |
Forfattere |
Beskrevet sammenheng |
Beskrevet kalsifisering |
|---|---|---|---|
Dentinogenesis imperfekta |
Pettiette et al. [56] Garrocho-Rangel et al. [57] |
«Relatert» |
«Alvorlig kalsifisering» |
Dentin dysplasi |
Type 1: Ozer et al. [58] Kim et al. [59] Gulati et al. [60] Type 2: O’Carrol et al. [55] |
«Relatert» |
«Alvorlig kalsifisering» «Pulpa steiner og redusert rotkanal» |
Osteogenesis imperfekta type I |
Thuesen et al. [61] |
«Relatert» |
«Moderat mot alvorlig kalsifisering» |
Systemisk sklerose |
Jung et al. [62] |
«Usikker» |
«Moderat kalsifisering – ett kasus» |
Familiær hyperfosfatemisk tumoral kalsinose |
Ramnitz et al. [63] Burkes et al. [64] |
«Relatert» |
«Kalsifisering av pulpa» og pulpa steiner |
Kronisk graft-vs-host sykdom |
Gomes et al. [65] |
«Relatert» |
«Alvorlig kalsifisering» |
Hyperkalsemi |
Nikiforuk et al. [66] |
«Usikker» |
«Dannelse av dentinbro – Dentinal bridging» |
Behandling av nyresykdommer i sluttstadiet |
Näsström et al. [67] Costantinides et al. [68] |
«Predisponerer» |
«Alvorlig innsnevring av pulpalumen» |
Hjerte- og karsykdommer |
Edds et al. [69] |
«Kan predisponere» |
Pulpa steiner |
Saethre-Chotzen syndrom |
Goho et al. [70] |
«Usikker» |
Pulpa steiner og «diffuse pulpakammer» |
Elfin facies syndrom |
Kelly et al. [71] |
«Predisponerer» |
«Små pulpakammer» og pulpa steiner |
Ehlers-Danlos syndrom type I |
Kapfere-Seebacher et al. [72] |
«Predisponerer» |
«Pulpa kalsifiseringer» og pulpa steiner |
Otodental syndrom |
Sedano et al. [73] |
«Kan predisponere» |
Pulpa steiner |
Marfan syndrom |
Bauss et al. [74] De Coster et al. [75] |
«Predisponerer» |
«Kalsifisering av pulpa» og pulpa steiner |
Langtidsbruk av glukokortikoider |
Gold et al. [76] Symons et al. [77] |
«Kan predisponere» |
«Alvorlig kalsifisering» |
Systemisk inntak av statiner |
Pettiette et al. [78] |
«Kan predisponere» |
«Alvorlig kalsifisering» |
Histologi – er det forskjell på kalsifiserte rotkanalsystem?
Histologiske undersøkelser av eldre tenner med sekundærdentinavsetning viser ikke tegn til vevsinflammasjon i pulpa. Sekundærdentin avsettes av primære odontoblaster. Selv om det forekommer individuelle variasjoner når det gjelder kalsifiseringsgrad, er dette ansett som en normal fysiologisk prosess [24].
Rotkanalsystem som er kalsifisert av tertiærdentin kan variere ut ifra type og grad av eksterne stimuli.
Reaksjonær dentinogenese opptrer ved milde pulpastimuli som emaljekaries, saktegående karies, grunne prepareringer, attrisjon, og erosjon [24] [28] [29] (figur 1). Histologisk, vil primære odontoblaster hovedsakelig gi et dentin med tubulært utseende.
Reparativ dentinogenese opptrer i tilfeller med større skade, hvor sekundære odontoblastlignende celler som er utviklet fra mesenkymale pulpaceller er involvert i reparasjonsprosessen [30] [31]. Dette kan skje ved hurtig progredierende karies, restorative prosedyrer og overdrevet uttørring av dentin, hvor de primære odontoblastene går tapt. Histologisk, vil et initialt lag av atubulært dentin bli dannet nær den sekundære eller primære dentinveggen. Strukturen på dette laget er beskrevet å ha en beinlignende struktur (osteodentin) [24]. Den videre dentindannelsen skjer ved hjelp av de odontoblastlignede cellene som har erstattet de primære odontoblastene [79] [80].
Tenner med kalsifiserte rotkanalsystem og en historikk med tanntraume viser sjeldent tegn på pulpainflammasjon [7] [35] [81]. Dette kan tyde på at denne type kalsifisering ikke er knyttet til en vedvarende inflammasjonsreaksjon i pulpa. Allikevel vil en inflammasjonsfri kalsifisert pulpa, enten på grunn av aldersforandringer eller traumehistorikk, ha endrede sirkulatoriske forhold. Dette kan gjøre slike tenner mindre motstandsdyktig mot nye traumepårvirkninger [82].
Kalsifisering av tannens rotkanalsystem etter et tanntraume vil avhenge av alvorligheten av tanntraumet, tannens rotutviklingsstadium, og opphavet til cellene som er involvert i tilhelingsprosessen [36]. I tilfeller hvor rotutviklingen er ufullstendig vil kalsifiseringsmønsteret ofte ha en beinlignende struktur, grunnet rekruttering av progenitorceller fra periodontalt vev [83]. På tenner hvor kalsifiseringen er basert på celler med opphav i pulpa vil en oftest finne dentinlignende struktur.
Kjeveortopedisk intrusjon er sett å kunne indusere vaskulære endringer i pulpa, med økt fibrotisering og kalsifisering i rotkanalsystemet [84]. Ved kjeveortopedisk ekstrusjon er det sett degenerasjon av odontoblastlaget, fortetninger av blodårer, vakuolisering, ødemdannelse, og fibrotisering av pulpavev [85]. Disse pulpaendringene synes å være forårsaket av redusert blodforsyning i pulpa.
Pulpasteiner forekommer ofte i friske tenner og er ansett som en normalanatomisk variant. Disse har ofte en glatt overflate med en dentinlignende struktur [1]. I tillegg kan pulpasteiner dannes ved kalsifisering av fibrøst og nedbrutt vev. Disse er ofte uregelmessige i form og er antatt å være forbundet med degenerative forandringer i pulpa [1].
Basert på overnevnte histologiske funn kan vi anta følgende. I tilfeller hvor hardvevsdannelse avhenger av pulpale progenitorceller med et kalsifiseringsmønster som starter koronalt i tannen, og som ligner dentin, vil det være mer sannsynlig å lokalisere en rotkanal. I tilfeller hvor hardvevsdannelse avhenger av periodontale progenitorceller, ofte med beinlignende innslag og hvor kalsifiseringen starter apikalt fra, er det mindre sannsynlig å identifisere en rotkanal.
Klassifisering
Klassifisering av rotkanalsystemet er baseres på intraorale røntgenbilder eller CBCT. Kalsifiseringsmønsteret klassifiseres og beskrives ofte som uaffisert, partielt kalsifisert eller totalt kalsifisert [20] [86]. Ved et partielt kalsifisert rotkanalsystem kan ikke rotkanalsystemet identifiseres som én sammenhengende enhet. For eksempel kan enten rotkanalen eller pulpakammer identifiseres separat. Ved total kalsifisering av rotkanalsystemet kan hverken rotkanal eller pulpakammer identifiseres. I tilfeller hvor rotkanalen så vidt kan identifiseres i den apikale 1/3 av roten, hører disse inn under gruppen total kalsifisering. Figur 3 illustrere de tre gruppene.
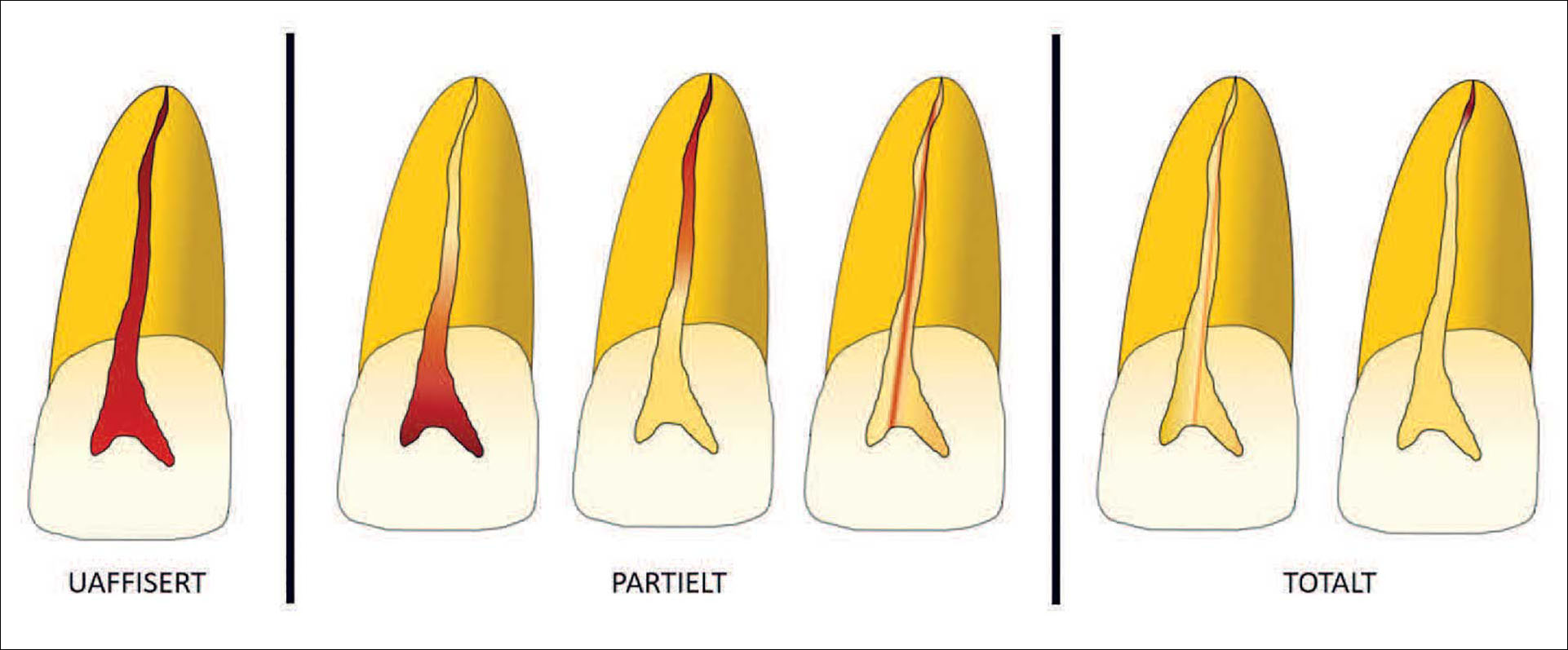
Figur 3. Illustrasjon viser klassifisering basert på kalsifiseringsmønster i rotkanalsystemet.
Endodontiske vurderinger
Preoperative hensyn
Sensibilitetstesting av tenner med kalsifiserte rotkanalsystem kan gi upålitelig resultat [81]. Utslag på sensibilitetstester synes også å avta med økende grad av kalsifisering [22]. Dette er av klinisk betydning, da fravær av positiv sensibilitet ikke er ensbetydende med pulpanekrose [11] [19] [22] [87]. Tilsvarende funn er rapportert ved sensibilitetstesting av tenner blant eldre pasienter [88].
Kalsifiseringsmønsteret bør vurderes ved røntgenologisk undersøkelse. Det kan være fordelaktig å identifisere rotkanalens plassering i roten (nedre, midtre eller øvre tredjedel). Den synlige rotkanalen bør vurderes om den er fullstendig, altså at den ikke deles opp av kalsifiseringer. Røntgenopptak med forskjellig projeksjonsretning kan være nyttig ved vurdering av rotkanalsystemet [89]. I tilfeller hvor det er vanskelig å identifisere rotkanalen kan utvidet røntgendiagnostikk med 3D modaliteter (f.eks. CBCT) være fordelaktig for videre behandlingsplanlegging.
Endodontisk behandling av kalsifiserte permanente tenner med traumehistorikk skal normalt ikke utføres før det foreligger kliniske og røntgenologiske tegn på sykdom i pulpa og/eller periapikale vev [90]. En avveiing mellom risiko og nytte bør være obligatorisk ved behandling av tenner med kalsifiserte rotkanalsystem.
En grundig preoperativ undersøkelse vil danne grunnlaget for å vurdere vanskelighetsgraden av den endodontiske behandlingen, og eventuelt behov for å henvise pasienten til en spesialist.
Kavumpreparering og lokalisering av kanaler
Å bevare tannsubstans er både ønskelig og avgjørende for tenners langtidsprognose [91]. Moderne endodontisk behandling sikter på å minimere tap av tannsubstans ved kavumpreparering og rotkanalinstrumentering, uten å gå på bekostning av den kjemo-mekaniske rengjøringen av rotkanalsystemet. Et kalsifisert rotkanalsystem kan føre til unødvendig tap av tannsubstans ved kavumpreparering og lokalisering av rotkanaler. Kalsifiseringer utgjør derfor en kompliserende faktor.
Tradisjonelle kavumprepareringer utføres typisk for frihånd med hurtiggående diamantbor, etterfulgt av saktegående forlengede bor eller ultralyd med tilhørende tupper (figur 4). For å lede tannlegen til rotkanalens plassering er tannanatomiske detaljer [6], gjentatte røntgenopptak i forskjellige vinkler [89], og i enkelte tilfeller CBCT viktige hjelpemiddel. Ved søk etter kalsifiserte rotkanaler er mikroskop ofte en nødvendighet [92].
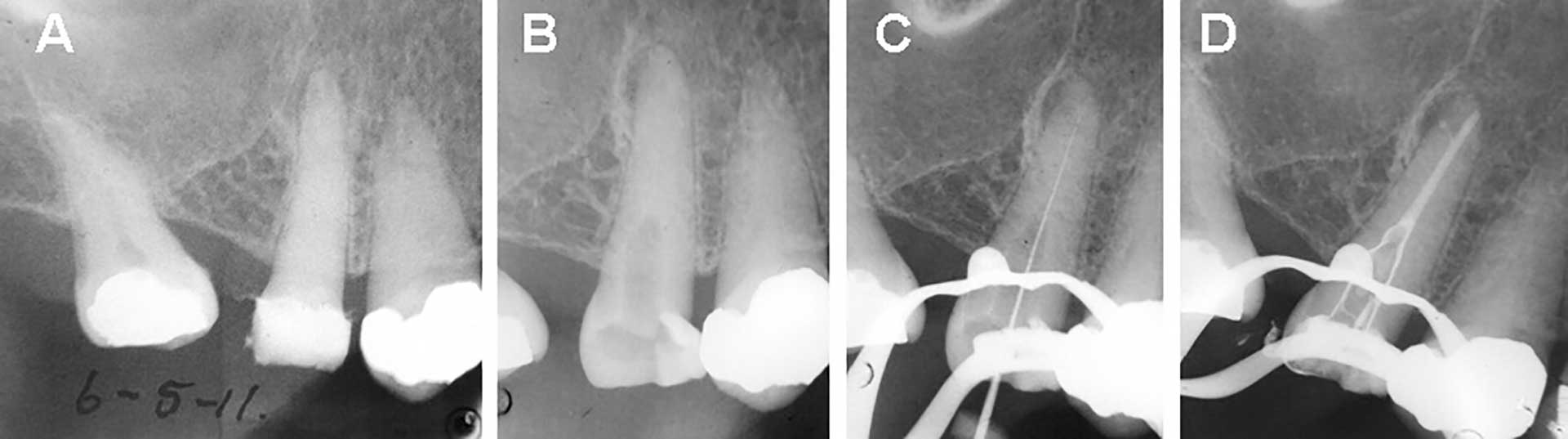
Figur 4. Røntgenbilder viser endodontisk behandling av kalsifisert rotkanal på tann 15. A: Tann 15 framstår som totalt kalsifisert med apikal patologi. B: Kontrollrøntgen av akseretning på tilkomstpreparering. Søk etter rotkanalen har ført til noe tap av tannsubstans. C: Indikatorrøntgen. D: Kontrollbilde av rotfylling med rotfyllingsmasse i bikanal som peker mot oppklarning i distal retning.
Nyere teknikker er utviklet med statisk eller dynamisk CBCT-ledet tilgang til rotkanalene. Teknikkene basere seg på en kombinasjon av data fra intraorale avtrykk og CBCT i et digitalt planleggingsverktøy. I planleggingsverktøyet lokaliseres kanalen og det fremstilles en statisk eller dynamisk «guide» som gir korrekt akse og dybde for tilhørende bor. Teknikken er vist å være trygg, samtidig som den kan redusere tap av tannsubstans [93]. Etter at kanalen er lokalisert utføres konvensjonell endodontisk behandling. Del 2 i dette nummeret av NTFs tidende, vil belyse CBCT ledet tilkomstpreparering i detalj.
Instrumentering, irrigasjon og obturering
Når rotkanalen er lokalisert, er det viktig å bruke tid på å etablere en glide-bane i det kalsifiserte rotkanalsystemet. Ved bruk av maskinelle systemer kan det være fordelaktig å instrumentere kanalsystemet med håndfiler til samme eller én ISO-dimensjon lavere enn den første maskinelle filen. Forskjellige produsenter har egne maskinelle filer for denne delen av instrumenteringen, ofte kalt «scout»- eller «glider»-filer. Slike roterende eller resiprokerende filsystemer vil likevel kreve at det er etablert renselengde med håndfiler før bruk av maskinelle systemer. Studier viser at etablering av en glide-bane kan gi en mer forutsigbar maskinell rotkanalinstrumentering [94] [95].
Bestemmelse av apikal dimensjon bør bestemmes fra tann til tann. Samtidig må ikke endelig apikal dimensjon og instrumentering være av en størrelse som ikke påvirker irrigasjon- og obtureringsprosedyrer negativt.
Irrigasjon følger konvensjonell endodontisk praksis med natriumhypokloritt og EDTA som førstevalg. Aktivering av irrigasjonsvæskene kan være fordelaktig for å øke de vevsoppløsende og antibakterielle egenskapene [96] [97] [98]. Obturering av rotkanalsystemet vil være avhengig av den enkelte tannleges foretrukne teknikk.
Andre restorative hensyn
Tenner med kalsifiserte rotkanalsystem vil ha redusert blodforsyning og celletetthet i pulpa, noe som gjør pulpa mer utsatt for ytre påvirkninger. En konservativ tilnærming til restaurering av slike tenner vil være gunstig for å unngå endodontiske komplikasjoner. En slik tilnærming er særlig aktuell i autotransplanterte tenner, hvor innvekst av bein kan endre hele forsvarsdynamikken i pulpa.
Konklusjoner
Kalsifiserte rotkanalsystem er utbredt i befolkningen. Etiologien bak kalsifisering av rotkanalsystemet kan deles inn etter lokale og systematisk faktorer. Bakenforliggende etiologiske faktorer er styrende for kalsifiseringsgrad og mønster. Kalsifiserte rotkanalsystem kan beskrives som uaffiserte, partielt eller totalt kalsifisert. Endodontisk behandling av kalsifiserte rotkanalsystem kan være komplisert og kreve spesiell tilpasning. Kavumpreparering og instrumentering av kalsifiserte rotkanalsystem er forbundet med høyrere risiko for prosedyreavvik. Når renselengde først er oppnådd, er det ingen prinsipiell forskjell mellom behandling av kalsifiserte rotkanalsystem og øvrige tenner.
Referanser
Fristad I, Berggren E. Structures and Functions of the Dentin-Pulp Complex. In: Berman LH, Hargreaves KM, editors. Cohen’s Pathways of the Pulp. 12 ed. St. Louise, Missouri, USA: Elsevier; 2020. p. 542-48.
Lamster IB, Asadourian L, Del Carmen T, Friedman PK. The aging mouth: differentiating normal aging from disease. Periodontol 2000. 2016;72:96-107. https://doi.org/10.1111/prd.12131.
Amir FA, Gutmann JL, Witherspoon DE. Calcific metamorphosis: a challenge in endodontic diagnosis and treatment. Quintessence Int. 2001;32:447-55.
McCabe PS, Dummer PMH. Pulp canal obliteration: an endodontic diagnosis and treatment challenge. Int Endod J. 2012;45:177-97. https://doi.org/10.1111/j.1365-2591.2011.01963.x.
AAE. American Association of Endodontist - Endodontic Case Difficulty Assessment Form and Guidlines Internet: American Association of Endodontists; 2005 [cited 2022 01.02]. Available from: https://www.aae.org/specialty/wp-content/uploads/sites/2/2019/02/19AAE_CaseDifficultyAssessmentForm.pdf
Krasner P, Rankow HJ. Anatomy of the pulp-chamber floor. J Endod. 2004;30:5-16. https://doi.org/10.1097/00004770-200401000-00002.
Cvek M, Granath L, Lundberg M. Failures and healing in endodontically treated non-vital anterior teeth with posttraumatically reduced pulpal lumen. Acta Odontol Scand. 1982;40:223-8. https://doi.org/10.3109/00016358209019816.
Tada S. The dilemma of advancing dentistry in “Super-Ageing” populations. Gerodontology. 2020;37:220-1. https://doi.org/10.1111/ger.12491.
López R, Smith PC, Göstemeyer G, Schwendicke F. Ageing, dental caries and periodontal diseases. J Clin Periodontol. 2017;44 Suppl 18:145-52. https://doi.org/10.1111/jcpe.12683.
Kristoffersen Ø, Nag OH, Drageset J, Fristad I. Endodontisk behandling hos eldre. Nor Tannlegeforen Tid. 2012;122:510-5. https://doi.org/10.56373/2012-7-10.
Holcomb JB, Gregory WB, Jr. Calcific metamorphosis of the pulp: its incidence and treatment. Oral Surg Oral Med Oral Pathol. 1967;24:825-30. https://doi.org/10.1016/0030-4220(67)90521-X.
Bratteberg M, Thelen DS, Klock KS, Bårdsen A. Traumatic dental injuries and pulp sequelae in an adolescent population. Dent Traumatol. 2021;37:294-301. https://doi.org/10.1111/edt.12635.
Rock WP, Grundy MC. The effect of luxation and subluxation upon the prognosis of traumatized incisor teeth. J Dent. 1981;9:224-30. https://doi.org/10.1016/0300-5712(81)90058-0.
Andreasen JO. Luxation of permanent teeth due to trauma. A clinical and radiographic follow-up study of 189 injured teeth. Scand J Dent Res. 1970;78:273-86. https://doi.org/10.1111/j.1600-0722.1970.tb02074.x.
Oikarinen K, Gundlach KK, Pfeifer G. Late complications of luxation injuries to teeth. Endod Dent Traumatol. 1987;3:296-303. https://doi.org/10.1111/j.1600-9657.1987.tb00638.x.
de Cleen M. Obliteration of pulp canal space after concussion and subluxation: endodontic considerations. Quintessence Int. 2002;33:661-9.
Andreasen FM, Pedersen BV. Prognosis of luxated permanent teeth--the development of pulp necrosis. Endod Dent Traumatol. 1985;1:207-20. https://doi.org/10.1111/j.1600-9657.1985.tb00583.x.
Andreasen FM, Zhijie Y, Thomsen BL, Andersen PK. Occurrence of pulp canal obliteration after luxation injuries in the permanent dentition. Endod Dent Traumatol. 1987;3:103-15. https://doi.org/10.1111/j.1600-9657.1987.tb00611.x.
Robertson A, Andreasen FM, Bergenholtz G, Andreasen JO, Norén JG. Incidence of pulp necrosis subsequent to pulp canal obliteration from trauma of permanent incisors. J Endod. 1996;22:557-60. https://doi.org/10.1016/s0099-2399(96)80018-5.
Jacobsen I, Kerekes K. Long-term prognosis of traumatized permanent anterior teeth showing calcifying processes in the pulp cavity. Scand J Dent Res. 1977;85:588-98. https://doi.org/10.1111/j.1600-0722.1977.tb02119.x.
Stålhane I, Hedegård B. Traumatized permanent teeth in children aged 7-15 years. Sven Tandlak Tidskr. 1975;68:157-69.
Oginni AO, Adekoya-Sofowora CA, Kolawole KA. Evaluation of radiographs, clinical signs and symptoms associated with pulp canal obliteration: an aid to treatment decision. Dent Traumatol. 2009;25:620-5. https://doi.org/10.1111/j.1600-9657.2009.00819.x.
Kuttler Y. Classification of dentine into primary, secondary, and tertiary. Oral Surgery, Oral Medicine, Oral Pathology. 1959;12:996-1001. https://doi.org/10.1016/0030-4220(59)90207-5.
Carvalho TS, Lussi A. Age-related morphological, histological and functional changes in teeth. Journal of Oral Rehabilitation. 2017;44:291-8. https://doi.org/10.1111/joor.12474.
Brännstrom M, Lindén LA, Johnson G. Movement of dentinal and pulpal fluid caused by clinical procedures. J Dent Res. 1968;47:679-82. https://doi.org/10.1177/00220345680470050201.
Baume LJ. The biology of pulp and dentine. A historic, terminologic-taxonomic, histologic-biochemical, embryonic and clinical survey. Monogr Oral Sci. 1980;8:1-220.
Bjørndal L, Thylstrup A, Ekstrand KR. A method for light microscopy examination of cellular and structural interrelations in undemineralized tooth specimens. Acta Odontol Scand. 1994;52:182-90. https://doi.org/10.3109/00016359409027594.
Bjørndal L, Darvann T, Thylstrup A. A quantitative light microscopic study of the odontoblast and subodontoblastic reactions to active and arrested enamel caries without cavitation. Caries Res. 1998;32:59-69. https://doi.org/10.1159/000016431.
Bjørndal L, Darvann T. A light microscopic study of odontoblastic and non-odontoblastic cells involved in tertiary dentinogenesis in well-defined cavitated carious lesions. Caries Res. 1999;33:50-60. https://doi.org/10.1159/000016495.
Simon SR, Berdal A, Cooper PR, Lumley PJ, Tomson PL, Smith AJ. Dentin-pulp complex regeneration: from lab to clinic. Adv Dent Res. 2011;23:340-5. https://doi.org/10.1177/0022034511405327.
Simon S, Smith AJ, Berdal A, Lumley PJ, Cooper PR. The MAP kinase pathway is involved in odontoblast stimulation via p38 phosphorylation. J Endod. 2010;36:256-9. https://doi.org/10.1016/j.joen.2009.09.019.
Staquet MJ, Durand SH, Colomb E, Roméas A, Vincent C, Bleicher F, et al. Different roles of odontoblasts and fibroblasts in immunity. J Dent Res. 2008;87:256-61. https://doi.org/10.1177/154405910808700304.
Yaacob HB, Hamid JA. Pulpal calcifications in primary teeth: a light microscope study. J Pedod. 1986;10:254-64.
Robertson A. A retrospective evaluation of patients with uncomplicated crown fractures and luxation injuries. Endod Dent Traumatol. 1998;14:245-56. https://doi.org/10.1111/j.1600-9657.1998.tb00848.x.
Torneck CD. The clinical significance and management of calcific pulp obliteration. Alpha Omegan. 1990;83:50-4.
Andreasen JO, Andreasen FM, Lauridsen E. Luxation Injuries of Permanent Teeth: General findings. In: O AJ, Andreasen FM, Andersson L, editors. Textbook and Color Atlas of Traumatic Injuries to the Teeth. Fifth ed: Wiley Blackwell; 2019. p. 413-42.
Fristad I, Vandevska-Radunovic V, Fjeld K, Wimalawansa SJ, Hals Kvinnsland I. NK1, NK2, NK3 and CGRP1 receptors identified in rat oral soft tissues, and in bone and dental hard tissue cells. Cell Tissue Res. 2003;311:383-91. https://doi.org/10.1007/s00441-002-0691-z.
Kvinnsland I, Heyeraas KJ, Byers MR. Regeneration of calcitonin gene-related peptide immunoreactive nerves in replanted rat molars and their supporting tissues. Arch Oral Biol. 1991;36:815-26. https://doi.org/10.1016/0003-9969(91)90031-o.
Vilhjálmsson VH, Knudsen GC, Grung B, Bårdsen A. Dental auto-transplantation to anterior maxillary sites. Dent Traumatol. 2011;27:23-9. https://doi.org/10.1111/j.1600-9657.2010.00952.x.
Kvinnsland S, Heyeraas K, Ofjord ES. Effect of experimental tooth movement on periodontal and pulpal blood flow. Eur J Orthod. 1989;11:200-5. https://doi.org/10.1093/oxfordjournals.ejo.a035986.
Vandevska-Radunovic V, Kristiansen AB, Heyeraas KJ, Kvinnsland S. Changes in blood circulation in teeth and supporting tissues incident to experimental tooth movement. Eur J Orthod. 1994;16:361-9. https://doi.org/10.1093/ejo/16.5.361.
Derringer KA, Jaggers DC, Linden RW. Angiogenesis in human dental pulp following orthodontic tooth movement. J Dent Res. 1996;75:1761-6. https://doi.org/10.1177/00220345960750100901.
Stenvik A, Mjör IA. Pulp and dentine reactions to experimental tooth intrusion: A histologic study of the initial changes. Am J Orthod. 1970;57:370-85. https://doi.org/10.1016/S0002-9416(70)90219-8.
Hamersky PA, Weimer AD, Taintor JF. The effect of orthodontic force application on the pulpal tissue respiration rate in the human premolar. Am J Orthod. 1980;77:368-78. https://doi.org/10.1016/0002-9416(80)90103-7.
Bauss O, Röhling J, Sadat-Khonsari R, Kiliaridis S. Influence of orthodontic intrusion on pulpal vitality of previously traumatized maxillary permanent incisors. Am J Orthod Dentofacial Orthop. 2008;134:12-7. https://doi.org/10.1016/j.ajodo.2006.07.033.
Bauss O, Schäfer W, Sadat-Khonsari R, Knösel M. Influence of orthodontic extrusion on pulpal vitality of traumatized maxillary incisors. J Endod. 2010;36:203-7. https://doi.org/10.1016/j.joen.2009.10.025.
Bauss O, Röhling J, Rahman A, Kiliaridis S. The effect of pulp obliteration on pulpal vitality of orthodontically intruded traumatized teeth. J Endod. 2008;34:417-20. https://doi.org/10.1016/j.joen.2008.01.006.
Delivanis HP, Sauer GJ. Incidence of canal calcification in the orthodontic patient. Am J Orthod. 1982;82:58-61. https://doi.org/10.1016/0002-9416(82)90547-4.
Javed F, Al-Kheraif AA, Romanos EB, Romanos GE. Influence of orthodontic forces on human dental pulp: a systematic review. Arch Oral Biol. 2015;60:347-56. https://doi.org/10.1016/j.archoralbio.2014.11.011.
von Böhl M, Ren Y, Fudalej PS, Kuijpers-Jagtman AM. Pulpal reactions to orthodontic force application in humans: a systematic review. J Endod. 2012;38:1463-9. https://doi.org/10.1016/j.joen.2012.07.001.
Popp TW, Årtun J, Linge L. Pulpal response to orthodontic tooth movement in adolescents: A radiographic study. Am J Orthod Dentofacial Orthop. 1992;101:228-33. https://doi.org/10.1016/0889-5406(92)70091-N.
Consolaro A, Consolaro RB. There is no pulp necrosis or calcific metamorphosis of pulp induced by orthodontic treatment: biological basis. Dental Press J Orthod. 2018;23:36-42. https://doi.org/10.1590/2177-6709.23.4.036-042.oin.
Shields ED, Bixler D, El-Kafrawy AM. A proposed classification for heritable human dentine defects with a description of a new entity. Arch Oral Biol. 1973;18:543-53. https://doi.org/10.1016/0003-9969(73)90075-7.
Lam EWN. Dental Anomalies. In: White SC, Pharoa MJ, editors. Oral Radiology: principles and interpretation. 6th ed. St. Louis, USA: Mosby Elsevier; 2008. p. 309-11.
O’Carroll MK, Duncan WK, Perkins TM. Dentin dysplasia: review of the literature and a proposed subclassification based on radiographic findings. Oral Surg Oral Med Oral Pathol. 1991;72:119-25. https://doi.org/10.1016/0030-4220(91)90202-n.
Pettiette MT, Wright JT, Trope M. Dentinogenesis imperfecta: endodontic implications: Case report. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1998;86:733-7. https://doi.org/10.1016/S1079-2104(98)90213-X.
Garrocho-Rangel A, Dávila-Zapata I, Martínez-Rider R, Ruiz-Rodríguez S, Pozos-Guillén A. Dentinogenesis Imperfecta Type II in Children: A Scoping Review. J Clin Pediatr Dent. 2019;43:147-54. https://doi.org/10.17796/1053-4625-43.3.1.
Ozer L, Karasu H, Aras K, Tokman B, Ersoy E. Dentin dysplasia type I: report of atypical cases in the permanent and mixed dentitions. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2004;98:85-90. https://doi.org/10.1016/j.tripleo.2004.01.005.
Kim JW, Simmer JP. Hereditary dentin defects. J Dent Res. 2007;86:392-9. https://doi.org/10.1177/154405910708600502.
Gulati N, Juneja S, Singh A, Singh I. A histological continuum between dentinogenesis imperfecta and dentin dysplasia: A case report with literature review. Indian J Dent Res. 2019;30:643-46. https://doi.org/10.4103/ijdr.IJDR_318_18.
Thuesen KJ, Gjørup H, Hald JD, Schmidt M, Harsløf T, Langdahl B, Haubek D. The dental perspective on osteogenesis imperfecta in a Danish adult population. BMC Oral Health. 2018;18:175. https://doi.org/10.1186/s12903-018-0639-7.
Jung S, Minoux M, Manière M-C, Martin T, Schmittbuhl M. Previously undescribed pulpal and periodontal ligament calcifications in systemic sclerosis: a case report. Oral Surg Oral Med Oral Pathol Oral Radiol. 2013;115:e47-e51. https://doi.org/10.1016/j.oooo.2012.09.091.
Ramnitz MS, Gafni RI, Collins MT. Hyperphosphatemic Familial Tumoral Calcinosis. In: Adam MP, Ardinger HH, Pagon RA, Wallace SE, Bean LJH, Gripp KW, et al., editors. GeneReviews®. Seattle (WA): University of Washington, Seattle, 1993
Burkes Jr. EJ, Lyles KW, Dolan EA, Giammara B, Hanker J. Dental lesions in tumoral calcinosis. J Oral Pathol Med. 1991;20:222-27. https://doi.org/10.1111/j.1600-0714.1991.tb00423.x.
Gomes CBF, Treister NS, Miller B, Armand P, Friedland B. Pulp Obliteration in a Patient with Sclerodermatous Chronic Graft-versus-Host Disease. J Endod. 2016;42:678-80. https://doi.org/10.1016/j.joen.2016.01.009.
Nikiforuk G, Fraser D, Poyton HG, McKendry JB. Calcific bridging of dental pulp caused by iatrogenic hypercalcemia. Report of a case. Oral Surg Oral Med Oral Pathol. 1981;51:317-9. https://doi.org/10.1016/0030-4220(81)90061-x.
Näsström K, Forsberg B, Petersson A, Westesson PL. Narrowing of the dental pulp chamber in patients with renal diseases. Oral Surg Oral Med Oral Pathol. 1985;59:242-6. https://doi.org/10.1016/0030-4220(85)90159-8.
Costantinides F, Castronovo G, Vettori E, Frattini C, Artero ML, Bevilacqua L, et al. Dental Care for Patients with End-Stage Renal Disease and Undergoing Hemodialysis. Int J Dent. 2018;2018:9610892. https://doi.org/10.1155/2018/9610892.
Edds AC, Walden JE, Scheetz JP, Goldsmith LJ, Drisko CL, Eleazer PD. Pilot Study of Correlation of Pulp Stones with Cardiovascular Disease. J Endod. 2005;31:504-06. https://doi.org/10.1097/01.don.0000168890.42903.2b.
Goho C. Dental findings in Saethre-Chotzen syndrome (acrocephalosyndactyly type III): report of case. ASDC J Dent Child. 1998;65:136-7.
Kelly JR, Barr ES. The elfin facies syndrome. Oral Surg Oral Med Oral Pathol. 1975;40:205-18. https://doi.org/10.1016/0030-4220(75)90153-x.
Kapferer-Seebacher I, Schnabl D, Zschocke J, Pope FM. Dental Manifestations of Ehlers-Danlos Syndromes: A Systematic Review. Acta Derm Venereol. 2020;100:152-60. https://doi.org/10.2340/00015555-3428.
Sedano HO, Moreira LC, de Souza RA, Moleri AB. Otodental syndrome: A case report and genetic considerations. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2001;92:312-7. https://doi.org/10.1067/moe.2001.116818.
Bauss O, Neter D, Rahman A. Prevalence of pulp calcifications in patients with Marfan syndrome. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2008;106:e56-e61. https://doi.org/10.1016/j.tripleo.2008.06.029.
De Coster PJA, Martens LCM, De Paepe A. Oral manifestations of patients with Marfan syndrome: A case-control study. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2002;93:564-72. https://doi.org/10.1067/moe.2002.121430.
Gold SI. Root canal calcification associated with prednisone therapy: a case report. J Am Dent Assoc. 1989;119:523-5. https://doi.org/10.1016/s0002-8177(89)94009-9.
Symons AL, Symons DJ. Pulpal obliteration related to long-term glucocorticosteroid medication. Spec Care Dentist. 1994;14:103-7. https://doi.org/10.1111/j.1754-4505.1994.tb01113.x.
Pettiette MT, Zhong S, Moretti AJ, Khan AA. Potential correlation between statins and pulp chamber calcification. J Endod. 2013;39:1119-23. https://doi.org/10.1016/j.joen.2013.06.005.
Gronthos S, Mankani M, Brahim J, Robey PG, Shi S. Postnatal human dental pulp stem cells (DPSCs) in vitro and in vivo. Proc Natl Acad Sci U S A. 2000;97:13625-30. https://doi.org/10.1073/pnas.240309797.
Bjørndal L, Sloan AJ. The dentin-pulp complex: structure, function, threats, and responses to external injury. In: Bjørndal L, Kirkevang L-L, Whitworth J, editors. Textbook of Endodontology. Third ed. Hobooken, N.J: Wiley-Blackwell; 2018. p. 11-32.
Patterson SS, Mitchell DF. Calcific metamorphosis of the dental pulp. Oral Surg Oral Med Oral Pathol. 1965;20:94-101. https://doi.org/10.1016/0030-4220(65)90272-0.
Bergenholtz G, Nyman S. Endodontic complications following periodontal and prosthetic treatment of patients with advanced periodontal disease. J Periodontol. 1984;55:63-8. https://doi.org/10.1902/jop.1984.55.2.63.
Heling I, Slutzky-Goldberg I, Lustmann J, Ehrlich Y, Becker A. Bone-like tissue growth in the root canal of immature permanent teeth after traumatic injuries. Endod Dent Traumatol. 2000;16:298-303. https://doi.org/10.1034/j.1600-9657.2000.016006298.x.
Lazzaretti DN, Bortoluzzi GS, Torres Fernandes LF, Rodriguez R, Grehs RA, Martins Hartmann MS. Histologic evaluation of human pulp tissue after orthodontic intrusion. J Endod. 2014;40:1537-40. https://doi.org/10.1016/j.joen.2013.10.039.
Mostafa YA, Iskander KG, El-Mangoury NH. Iatrogenic pulpal reactions to orthodontic extrusion. Am J Orthod Dentofacial Orthop. 1991;99:30-4. https://doi.org/10.1016/s0889-5406(05)81677-4.
Holan G. Tube-like mineralization in the dental pulp of traumatized primary incisors. Endod Dent Traumatol. 1998;14:279-84. https://doi.org/10.1111/j.1600-9657.1998.tb00853.x.
Schindler WG, Gullickson DC. Rationale for the management of calcific metamorphosis secondary to traumatic injuries. J Endod. 1988;14:408-12. https://doi.org/10.1016/s0099-2399(88)80126-2.
Farac RV, Morgental RD, Lima RK, Tiberio D, dos Santos MT. Pulp sensibility test in elderly patients. Gerodontology. 2012;29:135-9. https://doi.org/10.1111/j.1741-2358.2012.00623.x.
O’Connor RP, DeMayo TJ, Roahen JO. The lateral radiograph: An aid to labiolingual position during treatment of calcified anterior teeth. J Endod. 1994;20:183-4. https://doi.org/10.1016/S0099-2399(06)80332-8.
Krastl G, Weiger R, Filippi A, Van Waes H, Ebeleseder K, Ree M, et al. European Society of Endodontology position statement: endodontic management of traumatized permanent teeth. Int Endod J. 2021;54:1473-81. https://doi.org/10.1111/iej.13543.
Lang H, Korkmaz Y, Schneider K, Raab WH-M. Impact of Endodontic Treatments on the Rigidity of the Root. J Dent Res. 2006;85:364-8. https://doi.org/10.1177/154405910608500416.
Selden HS. The role of a dental operating microscope in improved nonsurgical treatment of “calcified” canals. Oral Surg Oral Med Oral Pathol. 1989;68:93-8. https://doi.org/10.1016/0030-4220(89)90121-7.
Connert T, Weiger R, Krastl G. Present status and future directions - Guided endodontics. Int Endod J. 2022;55 Suppl 4:995-1002. https://doi.org/10.1111/iej.13687.
Hartmann RC, Peters OA, de Figueiredo JAP, Rossi-Fedele G. Association of manual or engine-driven glide path preparation with canal centring and apical transportation: a systematic review. Int Endod J. 2018;51:1239-52. https://doi.org/10.1111/iej.12943.
Plotino G, Nagendrababu V, Bukiet F, Grande NM, Veettil SK, De-Deus G, Aly Ahmed HM. Influence of Negotiation, Glide Path, and Preflaring Procedures on Root Canal Shaping-Terminology, Basic Concepts, and a Systematic Review. J Endod. 2020;46:707-29. https://doi.org/10.1016/j.joen.2020.01.023.
Ahmad M, Pitt Ford TJ, Crum LA. Ultrasonic debridement of root canals: acoustic streaming and its possible role. J Endod. 1987;13:490-9. https://doi.org/10.1016/s0099-2399(87)80016-x.
Ahmad M, Pitt Ford TR, Crum LA. Ultrasonic debridement of root canals: an insight into the mechanisms involved. J Endod. 1987;13:93-101. https://doi.org/10.1016/s0099-2399(87)80173-5.
Gutarts R, Nusstein J, Reader A, Beck M. In vivo debridement efficacy of ultrasonic irrigation following hand-rotary instrumentation in human mandibular molars. J Endod. 2005;31:166-70. https://doi.org/10.1097/01.don.0000137651.01496.48.
English summary
Endodontic treatment of calcified teeth. Part 1: Calcifications in the root canal system
Pulp canal calcifications are common and will accumulate over time in the individual’s dentition. Based on 2D- or 3D-radiographs, the degree and pattern of calcification can be described as unaffected, partially calcified, or totally calcified. The etiological factors will be decisive for the degree and pattern of calcification, and whether it is possible to locate a root canal or not. The factors can be described as local or systemic. Sensibility testing of teeth with pulp canal calcifications may respond in an unreliable way. Therefore, endodontic treatment must not be performed without the presence of clinical and radiological signs of disease in the pulp and/or periapical tissues. Endodontic treatment of calcified root canal systems is time-consuming and associated with an increased risk of procedural mishaps and loss of tooth substance. During canal search in teeth with calcified root canal system, an operating microscope will be necessary. Comprehensive assessment of the risks and benefits should be mandatory when treating teeth with calcified root canal systems.
Skeie HG, Fristad I. Endodontisk behandling av kalsifiserte tenner. Nor Tannlegeforen Tid. 2024;134:940-8. doi:10.56373/2024-11-4
Korresponderende forfatter: Inge Fristad, e-post: inge.fristad@uib.no
Akseptert for publisering 04.06.2024
Artikkelen er fagfellevurdert
Artikkelen siteres som: Skeie HG, Fristad I. Endodontisk behandling av kalsifiserte tenner. Del 1: Kalsifiseringer i rotkanalsystemet. Nor Tannlegeforen Tid. 2024; 134: 940-8.
Nøkkelord: kalsifisering, endodonti, rotkanal, etiologi
Artikkelen er basert på spesialistarbeidet til Haakon Gramstad Skeie
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Skeie HG, Fristad I. Endodontisk behandling av kalsifiserte tenner. Nor Tannlegeforen Tid. 2024;134:940-8. doi:10.56373/2024-11-4
