Momenter ved tolkning av vitenskapelige artikler
Hovedbudskap
Kritisk lesning av metodedelen gir kunnskap om hvilke forutsetninger som ligger til grunn for forskningsresultatene
Forskningsresultater basert på studiedesign nær toppdelen av evidenspyramiden har generelt høyere grad av evidens enn resultater fra studier nær pyramidebasis
Hvordan og hvor mange deltakere som blir rekruttert, om studien er prospektiv eller retrospektiv, utført på et laboratorium eller på mennesker og tolkning av statistiske resultater har også betydning for tolkning av vitenskapelige artikler.
Kunnskap om studiedesign er viktig for å kunne kritisk vurdere vitenskapelige artiklers relevans og troverdighet. Slik kunnskap gjør det lettere for leseren å stille kritiske spørsmål til det evidensbaserte grunnlaget (bevisgrunnlag) for forskningsresultatene. Dette rangeres ofte i en såkalt evidenspyramide. Pyramiden antyder at resultatene fra studiedesign nær toppdelen har større evidens enn resultater fra studiedesign lavere nede på pyramiden. Systematiske oversiktsartikler og metastudier basert utelukkende på randomiserte kontrollerte studier («Randomized Controlled Trials», RCTs) anses å ha det høyest rangerte evidensbaserte grunnlaget. I en RCT fordeles testpersoner tilfeldig (randomisering) til en eller flere behandlingsgrupper eller en ubehandlet kontrollgruppe (evt. en «gullstandard-behandling»). Andre studiedesign som kohortstudier, kasus-kontrollstudier, tverrsnittsundersøkelser og kasuistikker/ekspertuttalelser vurderes vanligvis å ha en lavere grad av evidens. Studiedesign alene er likevel ikke tilstrekkelig for å kunne kritisk vurdere resultatet av vitenskapelige artikler. Øvrige faktorer, som representativitet og størrelse på deltakerutvalget, prospektive eller retrospektive studiedesign, laboratoriestudier eller studier på mennesker samt forståelse av statistiske resultater har også betydning ved vurdering av det evidensbaserte grunnlaget.
Den forskningsbaserte basis for klinisk odontologi utvides i stort tempo. I henhold til PubMed, en av de største søkemotorene innen helsevitenskap, er det frem til januar 2024, publisert nær 21 0000 vitenskapelige artikler med søkeordene «Clinical Dentistry». Bare i løpet av2023, ble det publisert ca. 34 000 artikler, og antallet øker hvert år.
Odontologisk praksis er likevel i hovedsak erfaringsbasert. Gode kliniske studier er vanskelige å gjennomføre og meget ressurskrevende. Følgelig har langt de fleste artikler innen odontologi en begrenset evidens. Det som skiller gode kliniske studier fra dem som er mindre gode, er i hvilken grad studiene er i stand til å kontrollere eller justere for alle kjente (og ikke sjelden ukjente) faktorer som kan påvirke resultatene og som kan føre til bias (skjevhet, forutinntatthet). [1] [2]
En kritisk tolkning av vitenskapelige artikler forutsetter derfor en kvalitativ vurdering av studiedesignet, men også innsikt i en del andre faktorer som kan påvirke tolkningen. [1] Eksempler på sistnevnte er hvordan og hvor mange deltakere som blir rekruttert, om studien er prospektiv eller retrospektiv, utført på et laboratorium eller på mennesker og hvordan statistiske resultater tolkes.
Hensikten med denne artikkelen er begrenset til å gi en oversikt over og diskusjon omkring en del viktige momenter knyttet til tolkning av vitenskapelige artikler.
Studiedesign
Et vesentlig problem når studiedesign skal vurderes, er at terminlogien ikke alltid er konsistent. [2] Av den grunn vil den etterfølgende beskrivelsen begrenses til noen viktige hovedkategorier.
En vanlig måte å rangere kliniske studier på, er å bruke den såkalte evidenspyramiden. Av denne finnes det mange varianter, men den som er gjengitt i figur 1 er en av de mest brukte. Figuren antyder at et studiedesign nær toppdelen av pyramiden har bedre evidens enn studier lavere nede. I det etterfølgende diskuteres noen av de vanligste studiedesignene med tanke på evidensbasert grunnlag og klinisk relevans.
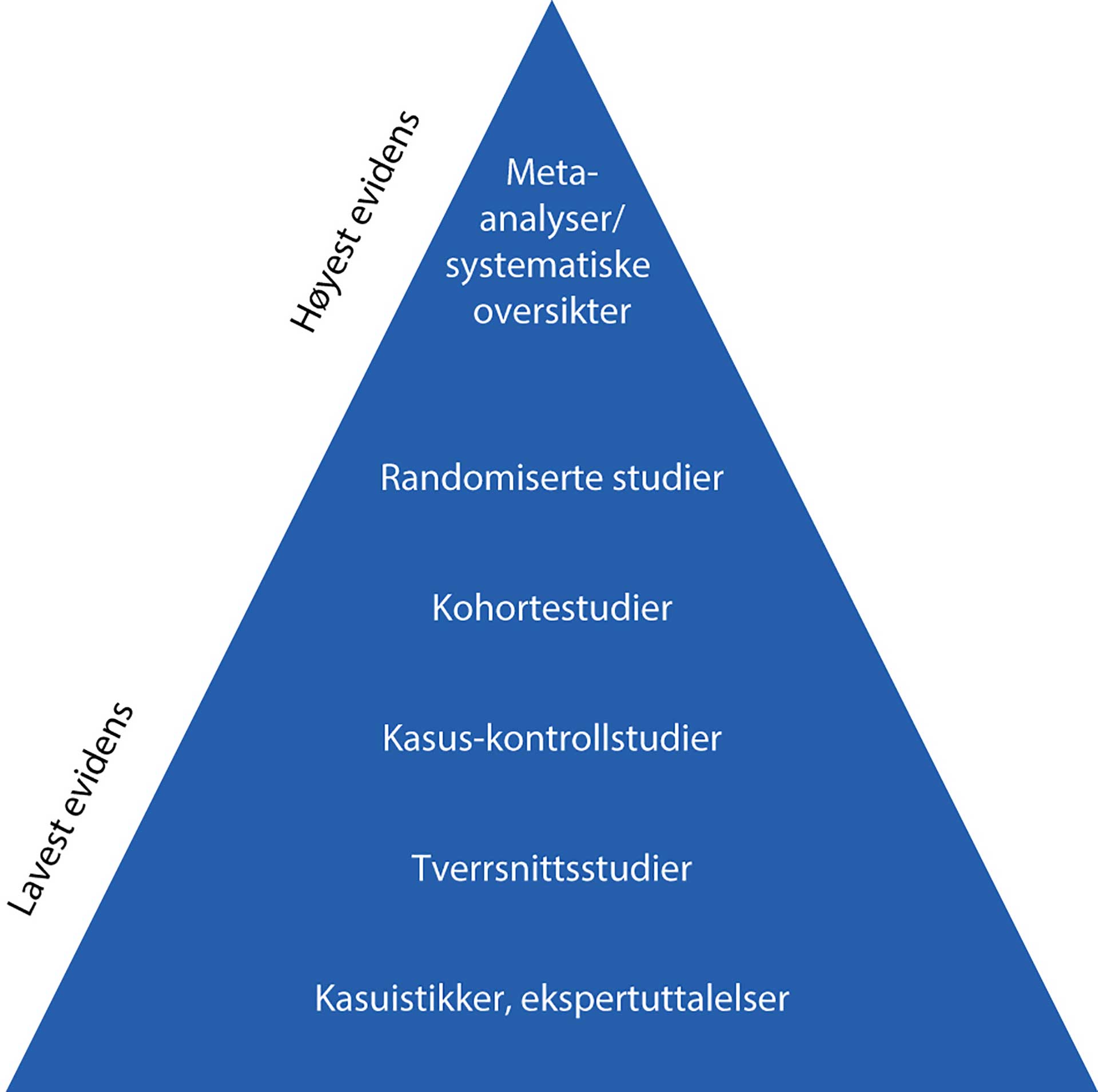
Figur 1. Evidenspyramide.
Systematiske litteraturoversikter og metastudier
Systematiske litteraturoversikter og metastudier rangeres høyest på evidenspyramiden fordi resultater fra flere studier sammenfattes og vurderes kritisk. [3] Av den grunn kan det oppnås et bredere og sikrere vurderingsgrunnlag for å kunne trekke mer allmenngyldige konklusjoner enn ved funn fra enkeltstudier. Ved systematiske litteraturoversikter brukes de viktigste søkemotorene (eksempelvis PubMed, Scopus, Cochrane libraries, Web of Sciences etc.) som kilder for en systematisk utvelgelse av aktuelle publikasjoner innen et bestemt emne og tidsrom. Hvilke artikler som skal inkluderes defineres på forhånd av forfatterne ved hjelp av spesifikke inklusjons- og eksklusjonskriterier.
Systematiske litteraturoversikter og metastudier kan kun plassers på toppen av evidenspyramiden dersom de er utført etter en allment akseptert metode, slik som anbefalt i «Preferred Reporting Items for Systematic Reviews and Meta-Analyses» (PRISMA), og basert på studiedesign med høy kvalitet (eksempelvis RCT). [4]
Rent praktisk ekskluderes alle publikasjoner som ikke tilfredsstiller inklusjonskriteriene, ofte i flere trinn. Det er ikke uvanlig at første utvalg inneholder flere hundre artikler, mens det endelige utvalget, som tilfredsstiller alle inklusjonskriterier, bare består av ett fåtall artikler. Hver av disse blir kritisk gjennomgått, sammenlignet og rangert kvalitativt ved hjelp av systemer som «Quality of Reporting Metaanalyses» (QUORUM) og «A Measurment Tool to Assess Systematic Reviews» (AMSTAR). Resultatbeskrivelsen i systematiske litteraturoversikter er basert på funn fra denne kritiske vurderingen av enkeltstudier. Deretter trekkes det gjerne en konklusjon som viser status presens innenfor emnet. Ved metastudier slås data fra flere studier sammen som deretter analyseres statistisk. Den statistiske metaanalysen er betinget av at de publiserte data er av slik karakter at dette er teknisk mulig.
Randomiserte kontrollerte studier («Randomized Controlled Trials», RCTs)
Ved RCT sammenlignes en eller flere behandlingsgrupper med en ubehandlet kontrollgruppe eller en «gullstandard-behandling». [5] Testpersonene fordeles tilfeldig i grupper (randomisering).
Hensikten ved RCT er å dokumentere en reell behandlingseffekt. Ved å randomisere deltakerne til ulike grupper, sikres at både observerbare og ikke-observerbare faktorer («confounders»), eksempelvis diett, blodtrykk, røyking etc., blir tilfeldig fordelt før behandling. [6] Gruppene blir dermed balanserte og sammenlignbare.
Å randomisere testgruppene reduserer ikke bare risikoen for utvalgsbias, men også for mulig placebo- eller nocebo-effekter (forverring av et symptom eller bivirkninger av en behandling, som skyldes negative forventninger).
RCT gjøres alltid over tid slik at endring og utvikling av utfall av testgruppene kan observeres. [7] Ved lange observasjonsperioder kan frafall («dropout») av deltakere være et problem. «Dropout» kan skyldes sykdom, dødsfall, at deltakeren har flyttet, at deltakeren ikke lenger er motivert for å delta i studien etc. Dersom«dropout-gruppen» på noen måte avviker fra øvrige deltakere, vil det kunne føre til bias. [2] [8] Det bør da utføres sensitivitetstester for å sammenligne avvik i viktige egenskaper mellom «dropout-gruppen» og det opprinnelige utvalget. Viser testen at avviket er statistisk signifikant, vil frafallet kunne underminere påviste behandlingsforskjeller mellom grupper.
Ved RCTs bør behandler og deltaker ideelt sett være uvitende om hvilken behandling som utføres. [9] Da er studien«dobbelblindet». Et eksempel på dette kunne være å teste en smertestillende tablett mot en tablett uten virkestoff, der begge typer tabletter har samme form, størrelse og farge. Dersom bare én av aktørene er uvitende om behandlingen, er studien«enkeltblindet». En sammenligning mellom suturmaterialers sårstabiliserende egenskaper kan være et eksempel på dette da behandler, i motsetning til deltaker, lett kan se forskjeller på suturmaterialenes farge og struktur. For noen kliniske prosedyrer vil blinding være umulig siden forskjeller i utført behandling gir merkbare eller synlige forskjeller for begge aktører. Uavhengig av årsak, vil manglende blinding eller bare enkeltblinding svekke studiens evidensbaserte grunnlag.
Kohortstudier
Ved kohortstudier observeres ofte en stor gruppe individer (for eksempel registre) over tid for å se hvem som utvikler sykdom eller for å teste effekten av ulike typer behandling. Gruppen karakteriseres ved at deltakerne har noen felles og nærmere definerte egenskaper eller omstendigheter, eksempelvis knyttet til demografiske forhold, yrke, helsetilstand eller andre forhold etc. Dette studiedesignet er velegnet for å kartlegge eventuelle risikofaktorer for utvikling av sykdom samt å beregne sammenhenger mellom eksponering og sykdomsforekomst og dermed risiko for sykdom og når sykdom sannsynlig vil kunne inntreffe. [10]
Kohortstudier krever mange deltakere, særlig ved lav-prevalente tilstander, de kan være ressurskrevende og kostbare. På samme måte som ved RCT, kan «dropout» være et problem. [8] [6]
Kasus-kontrollstudier
Dette er en type studier der en gruppe mennesker med en eksisterende tilstand eller en sykdom sammenlignes med en kontrollgruppe uten sykdommen. [11] Deretter undersøkes i hvilken grad de to gruppene har tidligere vært eksponert for ulike faktorer som kanskje kan være relatert til sykdommen. Dette kan for eksempel være røyking, høyt sukkerinntak etc., for derved å kunne identifisere årsaker til at eksponert individ utviklet sykdom. Det er av avgjørende betydning at kontrollgruppen er mest mulig sammenlignbar med sykdomsgruppen. Om dette kravet ikke oppfylles, vil konklusjonene kunne være biased.
Det kan være vanskelig å måle eksponeringen korrekt, særlig om man skal gå langt tilbake i tid, og/eller om det er multifaktorielle årsakssammenhenger. Kasus-kontrollstudier er alltid retrospektive. Ved slike design er det en risiko for «recall-bias» ved at deltaker- og kontrollgruppen kan huske historiske forhold forskjellig.
En vesentlig fordel med et kasus-kontroll-design er at studiene er enkle og kostnadseffektive å gjennomføre. [12] Dette studiedesignet brukes gjerne ved sjeldne sykdomstilstander som utvikler seg langsomt. I odontologisk sammenheng har designet vært brukt ved sykdomstilstander som karies, periodontitt [13] eller kjeve-, leppe-, ganespalte etc. [14]
Tverrsnittstudier
Tverrsnittstudier brukes ofte til å kartlegge ulike sykdommer i en befolkningsgruppe på et bestemt tidspunkt og for å klargjøre hvordan disse sykdommene utvikler seg og påvirker hverandre. Studiedesignet er også velegnet til å kartlegge assosiasjoner mellom sykdom og risikofaktorer. I norsk odontologisk sammenheng har tverrsnittstudier være brukt ved tannbehandlingsangst [15], karies, [16] relasjonen mellom hjerte-karsykdommer og periodontitt [17] etc.
Ved tverrsnittstudier går vanligvis innsamlingen av forskningsdata raskere og prosessen er mindre resurskrevende enn ved longitudinelle undersøkelser. I motsetning til kohort-, kasus-kontrollstudier eller RCT, kan ikke tverrsnittstudier kartlegge sykdomsutvikling over tid eller dokumentere årsakssammenhenger.
Kasuistikker, kasus-serier
I en kasuistikk beskrives ofte en patologisk tilstand, en behandling eller en prosedyre hos et enkelt individ. En kasus-serie består av noen få individer. Ofte rapporteres uvanlige tilstander som det ikke finnes evidensbasert standard behandling for. Noen ganger blir behandlingsresultatet fulgt over tid. [18] Gode kasuistikker eller kasus-serier er karakterisert ved at de gir læringspunkter som kan være nyttige for klinikere som står overfor tilsvarende behandlingsproblemer, eller vise tendenser eller trender som kan gi grunnlag for større oppfølgingsstudier.
Siden kasuistikker bare omfatter et eller noen få individer, er som oftest verdien begrenset til den konkrete prosedyren og/eller det behandlingsresultat som beskrives. Kasuistikker kan imidlertid noen ganger være så epokegjørende at de får allmenn betydning. Et klassisk eksempel på dette er beskrivelsen av den første pasienten som i 1941 ble behandlet med penicillin. [19]
Ekspertuttalelser
Dersom ekspertuttalelser gis uten referanser til dokumenterte, evidensbaserte studier, må de betraktes som erfaringsbaserte, selv om de kan gi nyttig klinisk informasjon. [20] Slike uttalelser vil ofte være basert på prosedyrer eller behandlinger som kan være vellykkede i hendene til eksperten, men som ikke nødvendigvis fungerer like bra i andres hender.
Øvrige faktorer som kan påvirke det evidensbaserte grunnlaget for studien
Pasientutvalg
En viktig forutsetning for å kunne vurdere det evidensbaserte grunnlag for studien, er at deltakerutvalget er representativt for den populasjonen (en gruppe mennesker karakterisert ved for eksempel, kjønn, alder, utdanning, bosted og lignende) og tilstanden som undersøkes. Derfor er det viktig at deltakerutvalget er tilstrekkelig stort, da representativitet er vanskeligere å sikre med små utvalg. Små utvalg kan likevel gi forholdsvis sikre konklusjoner dersom gruppeforskjellene er store. At en studie er gjort på små utvalg har ofte sin bakgrunn i at større utvalg vil være for ressurskrevende å gjennomføre. [21] På små utvalg blir allmenngyldigheten av funnene og det evidensbaserte grunnlaget redusert sammenlignet med studier med større utvalg. [22] Ved noen studiedesign (eksempelvis RCT), kan dessuten utvalgskriteriene være så restriktive for å redusere risikoen for bias, at det går ut over representativiteten. [23]
Det er også viktig at deltakerne i studien er rekruttert på en slik måte at forskeren har mist mulig anledning til å påvirke utvalget. Ideelt sett kan det foregå ved at en datamaskin gjør et tilfeldig utvalg i populasjonen, men av praktiske og ressursmessige grunner vil fortløpende utvalg, der alle deltakere innen et definert tidsrom inkluderes, ofte være det eneste praktisk mulige. Studier basert på slike utvalgsmetoder kan imidlertid øke risikoen for bias og redusere det evidensbaserte grunnlaget.
Prospektive/ retrospektive studier
I en prospektiv studie (eksempelvis ved RCT og kohortstudier), følges en gruppe individer som er utsatte for en eksponering (eksempelvis ved røyking) over tid. Dermed kan sykdomsutviklingen følges. De vesentligste fordelene ved prospektive studier er knyttet til at forskeren i stor grad kan styre rekrutteringsprosessen og velge det mest egnede studiedesign. Slike studier er dermed mindre utsatt for bias og ikke-observerbare faktorer, og sykdomsårsaker kan da bedre belyses. Ulempen er at de er kostbare og krever lang oppfølgingstid.
Er studien retrospektiv (eksempelvis kasus-kontrollstudier), ser man på historiske data – altså hva som har forekommet tilbake i tid, og data hentes fra journaler eller tidligere deltaker-intervjuer. [24] Dette gjør slike studier enklere og billigere å gjennomføre enn prospektive studier. Retrospektive studier kan være fordelaktige ved tilstander med lange latensperioder. Den vesentligste ulempen er at den opprinnelige studien sjelden er spesielt designet for formålet. Forskeren er derfor avhengig av at deltakerutvalget og eksisterende data er fullt ut relevante for problemstillingen.
Prospektive studier anses vanligvis å ha bedre evidensbasert grunnlag enn retrospektive, men dette kan variere avhengig av hvilke forsøksbetingelser som foreligger.
Laboratorie- / kliniske studier
Langt de fleste publikasjoner i odontologi er laboratoriestudier («in vitro»). Slike studier brukes eksempelvis ved utprøving av nye materialer eller metoder, der fysiske og biologiske egenskaper kartlegges. Fysiske faktorer som temperatur, lufttrykk og -fuktighet etc. som kan påvirke resultatene, er vanligvis forholdsvis enkle å kontrollere. Laboratoriestudier vil imidlertid ofte bare i begrenset grad kunne etterligne de spesielle aggressive kjemiske, termiske eller mekaniske forhold som forekommer i munnhulen, noe som reduserer resultatenes kliniske relevans. Særlig på områder der kliniske studier mangler, vil likevel funn fra laboratoriestudier kunne være klinisk relevante og dessuten danne basis for mer kostbare kliniske studier.
Resultater fra gode kliniske studier («in vivo») vil vanligvis være mere direkte klinisk relevante enn laboratoriestudier da de utføres på mennesker. Dermed vil både de spesielle intraorale forhold nevnt ovenfor, men også generelle medisinske, psykiske, praktiske, logistiske, psykososiale og økonomiske forhold kunne spille en rolle og resultatene bli mer relevant for alminnelig praksis.
Vurdering av statistikken
Statistiske analyser innebærer verken mer eller mindre enn at innsamlede data bearbeides i algoritmer. Er ikke data som inngår i studien vurdert som fullt ut tilpasset og relevant for problemstillingen eller er innsamlet på en adekvat måte, vil ikke de statistiske resultatene være meningsfylte.
Et annet viktig forhold som må også vurderes, er om en statistisk signifikant p-verdi (vanligvis p<0,05) også er klinisk signifikant, ettersom de to begrepene ikke alltid er sammenfallende. [25] Riktignok vil enhver statistisk signifikant p-verdi med stor grad av sannsynlighet vise en reell forskjell mellom grupper eller assosiasjoner, men med et stort antall forsøkspersoner, vil de faktiske forskjellene eller assosiasjonene kunne være så små at de er uten praktisk klinisk betydning.
Diskusjon
I teksten ovenfor, er det gjort vurderinger av noen momenter av betydning for tolkning av vitenskapelige artikler. Slike vurderinger er viktige fordi de gir nødvendig bakgrunn for å overveie mulig klinisk relevans av forskningsresultater. Til samme formål kan klinikere også ha god nytte av «God klinisk praksis i tannhelsetjenesten – en veileder i bruk av faglig skjønn ved nødvendig tannbehandling» [26], som er basert på slike vurderinger. Dessuten gir «Helsebiblioteket» [27] gratis adgang til oppslagsverk, retningslinjer, databaser og andre kunnskapsressurser med nyttig informasjon om helseforskning.
Det er ellers viktig å merke seg at forskningsresultater alene har liten verdi, uten at de vurderes opp mot de metodene som er anvendt i eksperimentet. Kunnskap om studiedesign og øvrige forhold som kan påvirke tolkningen, er derfor nøkkelen til kritisk forståelse og vurdering av forskningsresultatene. Uansett er ikke vurderingene alltid enkle å foreta – noen ganger fordi metodebeskrivelsen er ufullstendig eller på annen måte utilfredsstillende.
I gode artikler er det gjort forsøk på å beskrive objektivt hvilke begrensninger av funnenes allmenngyldighet som finnes, både med tanke på det valgte forskningsdesign og hvilke øvrige faktorer som kan modifisere tolkningen av resultatene. Dessverre mangler ofte slik selvvurdering, og selv om den finnes, er den ikke alltid objektiv eller fullstendig. Derfor må leseren selv foreta en kritisk vurdering av de metodiske forhold og på basis av dette og sin kliniske erfaring bedømme i hvilken grad resultatene har klinisk relevans.
Av mange grunner kan ikke alle studier være ideelle. Dersom eksempelvis en pilotstudie eller erfaringsbasert kunnskap indikerer at en kontroll- eller standardbehandling er åpenbart betydelig dårligere (eller bedre) enn den eksperimentelle behandling, vil studien kunne være uetisk å gjennomføre. I stedet må velges et design lenger nede på evidenspyramiden som ikke innebærer slike etiske problemstillinger. Likeledes blir noen ganger studier gjennomført med små deltakerutvalget av praktiske eller økonomiske grunner eller fordi den tilstanden som undersøkes er så sjelden at det kan være vanskelig å rekruttere et ideelt antall deltakere. Det kan også være tekniske, sosiale, logistiske eller andre grunner til at en ideell studie ikke kan gjennomføres. Selv om slike studier ikke har like stort evidensbasert grunnlag som en optimal RCT, vil resultatene, sammen med andre studier, likevel bidra til å beskrive det vitenskapelige landskapet.
Konklusjon
Hensikten med denne artikkelen er å gi en kort bekrivelse av noen viktige studiedesign og øvrige forhold som også må tillegges vekt ved tolkning av vitenskapelige artikler. Slik tolkning og vurdering av eventuell klinisk relevans av resultater fra en vitenskapelig artikkel er ikke mulig uten først å ha lest artikkelens metodedel. Kunnskap om den metoden som er brukt, er nøkkelen til kritisk forståelse. Klinikeren selv må foreta en kritisk vurdering av den beskrevne metoden, og på den basis, sammenholdt med egen klinisk erfaring, bedømme i hvilken grad resultatene har klinisk relevans.
Takk
Takk til professor emeritus Knut Norvald Leknes, professor Stein Atle Lie og professor emeritus Nils Roar Gjerdet for råd og veiledning ved utarbeidelse av manuskriptet.
Referanser
Greehalgh T. How to read a paper: Assessing the methodological quality of published papers. BMJ. 1997;315(7103):305-8.
Jokstad A. Please do not feel bad, identifying the precise study design used in clinical research may be a challenge. Clin Exp Dent Res. 2019;5:181-3. https://doi.org/10.1002/cre2.211
Gopalakrishnan S, Ganeshkumar P. Systematic Reviews and Meta-analysis: Understanding the Best Evidence in Primary Healthcare. J Family Med Prim Care. 2013;1:9-14, https://doi.org/10.4103/2249-4863.109934
Gopal DP, Chetty U, O’Donnell P, Gajria C, Blackadder-Weinstein J. Implicit bias in healthcare: clinical practice, research and decision making. Future Healthc J. 2021 Mar;8(1):40-48. https://doi.org/10.7861/fhj.2020-0233.
Hannan EL. Randomized Clinical Trials and Observational Studies: Guidelines for Assessing Respective Strengths and Limitations. JACC: Cardiovascular Interventions 2008;1:211–7, https://doi.org/10.1016/j.jcin.2008.01.008.
VanderWeele TJ, Shpitser I. On the definition of a confounder. Ann. Statist. 2013;41: 196-220, https://doi.org/10.1214/12-AOS1058.
Mukilvannan G, Gjerde CG, Schriwer C, Lie SA, Berg E, Gjengedal H. An 8-10 Year Follow-up of Denture Satisfaction and Oral Health-Related Quality of Life with Implant-Retained Mandibular Overdentures. Int J Prosthodont. 2021;34(3):317–323. https://doi.org/10.11607/ijp.7521
Lydersen S. Frafallsanalyse. Tidsskr Nor Legeforen. 2022 https://doi.org/10.4045/tidsskr.22.0510.
Miller LE, Stewart ME. The blind leading the blind: Use and misuse of blinding in randomized controlled trials. Contemp Clin Trials. 2011;2:240-3.
Simpson MR. Kohortstudier. Tidsskr Nor Legeforen. 2021, https://doi.org/10.4045/tidsskr.21.0511.
Lydersen S. Kasus-kontroll-studier. Tidsskr Nor Legeforen. 2019, https://doi.org/10.4045/tidsskr.19.0575.
Brunette DM. Critical thinking. Understanding and evaluating dental research. Quintessence Publishing Co. Chicago 1996, p 125-130.
Pallier A, Karimova A, Boillot A, et al. Dental and periodontal health in adults with eating disorders: A case-control study. J Dent. 2019;84:55-9. https://doi.org/10.1016/j.jdent.2019.03.005.
Hasslöf P, Twetman S. Caries prevalence in children with cleft lip and palate—a systematic review of case-control studies. Int J Paediatr Dent. 2007;5:313-9. https://doi.org/1111/j.1365 -263X.2007.00847.x.
Nermo H, Willumsen T, Rognmo K, Thim JC, Wang E CA, Johnson J-AK. Dental anxiety and potentially traumatic events: cross-sectional study based on the Tromsø Study-Tromsø 7. BMC Oral Health. 2021:1;600. https://doi.org/10.1186/s12903-021-01968-4
Rødseth SC, Høvik H, Schuller AA, Bjertness E, Skudutye-Rysstad R. Dental caries in a Norwegian adult population, the HUNT4 oral health study; prevalence, distribution and 45-year trends. Acta Odontol Scand. 2023;81:202-10. https://doi.org/10.1080/00016357.2022.2117735
Petrenya N, Hopstock LA, Holde GE, Oscarson N, Jönsson B. Relationship between periodontitis and risk of cardiovascular disease: Insights from the Tromsø Study. J Periodontol. 2022;93:1353-65 .
Sæthre T, Berg, E, Bunæs DF, Leknes KN. Complication following frenectomy: A case report. Clin Case Rep. 2021;9:e04888. https://doi.org/10.1002/ccr3.4888.
Fletcher C, First clinical use of penicillin. Brit Med J 1984;289:22-9.
Berg E, Isidor F, Öwall B. Prosthodontics for the elderly patient. Nor Tannlegeforen Tid 2017;127:120-6.
Pripp AH. Når utvalget er lite. Medisin og tall. Tidsskr Nor Legeforen. 2023. https://doi.org/10.4045/tidsskr.23.0085.
Lie SA. Konfidensintervall. Nor Tannlegeforen Tid. 2023;133:788. https://doi.org/10.56373/2023-10-5
Monti S, Grosso V, Todoerti M, Caporali R. Randomized controlled trials and real-world data: differences and similarities to untangle literature data. Rheumatology 2018;57:54-8 https://doi.org/10.1093/rheumatology/key109.
Nylenna M. Prospektiv og retrospektiv. Tidsskr Nor Legeforen. 2016;136:936. https://doi.org/10.4045/tidsskr.16.0280.
Lie SA. Statistisk signifikans og p-verdi. Nor Tannlegeforen Tid. 2023;133:132 https://doi.org/10.56373/2023-2-10.
God klinisk praksis i tannhelsetjenesten – en veileder i bruk av faglig skjønn ved nødvendig tannbehandling. https://www.helsebiblioteket.no.
Helsebiblioteket.no. https://www.helsebiblioteket.no
English summary
Issues of interpretation of scientific articles
Knowledge of study designs is important in order to evaluate critically the relevance and credibility of scientific articles. Such knowledge enables the reader to ask critical questions regarding the evidence base of research outcomes. The quality of this evidence may be arranged in a so-called evidence pyramid, which indicates that results from study designs near the top of the pyramid have higher evidence than those lower down. Systematic Reviews and Meta-analyses, if based solely on Randomised Controlled Trials (RCT), are considered to have the highest-ranking evidence base. In an RCT, the test persons are distributed in a random way (randomisation) to one or more treatment groups and a control group (or a gold standard treatment). Other study designs, such as cohort studies, case-control studies, cross-sectional studies, case reports and expert opinions, are normally regarded as having lesser evidence base. However, study designs alone are not sufficient to enable a critical evaluation of outcomes of scientific articles. Other factors, such as representativeness and number of selected patients, prospective or retrospective studies, laboratory or human studies and interpretation of statistical results, are also important when evaluating the evidence base.
Berg E. Momenter ved tolkning av vitenskapelige artikler. Nor Tannlegeforen Tid. 2024;134:932-7. doi:10.56373/2024-11-3
Korresponderende forfatter: Einar Berg, E-post: einar.berg@uib.no
Akseptert for publisering 22.07.2024
Artikkelen er fagfellevurdert
Artikkelen siteres som: Berg E. Momenter ved tolkning av vitenskapelige artikler. Nor Tannlegeforen Tid. 2024; 134: 932-7.
Søkeord: Research design, Methods, Epidemiology, Evidence-based Dentistry, Patient selection
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Berg E. Momenter ved tolkning av vitenskapelige artikler. Nor Tannlegeforen Tid. 2024;134:932-7. doi:10.56373/2024-11-3
