Biologiske effekter av dentale adhesivsystemer
Hovedbudskap
Innholdsstoff i dentale adhesivsystemer kan skade celler og vev
Allergiske reaksjoner er det som oftest observeres i klinikken
Kunnskap om innholdsstoffenes toksisitet og håndtering med fokus på å begrense eksponering reduserer faren for skadelige effekter
Vakuumsug, ventilasjon og bruk av kofferdam er gode tiltak for å begrense eksponeringen
Utviklingen av dentale adhesivsystemer startet for mer enn 70 år siden, men ble vanlig i bruk på 80-tallet. I moderne operativ tannbehandling står adhesive teknikker helt sentralt, og materialene benyttes i et bredt spekter av behandlingsmetoder. Adhesivsystemer er en gruppe av svært komplekse materialer med stor variasjon i kjemisk sammensetning og anvendelsesmetode.
Systemene som brukes i dag er relativt enkle å bruke, men man må være klar over at mange innholdsstoffer som for eksempel syrer og monomerer har et generelt toksisk potensial og kan fremkalle allergi. For best mulig å forstå skadepotensialet som ligger i materialene, er det derfor viktig å være klar over innholdsstoffer og eksponeringsrisiko både for pasient og tannhelsepersonell. Med god kunnskap om dette, så har man også et godt verktøy for å minimalisere eksponeringen og dermed faren for skadelige effekter.
Dentale adhesivsystemer (bondingsystemer) ble første gang introdusert i 1949. Oskar Hagger (ved De Trey) laget, en sur, selvetsende adhesiv (Sevriton Cavity Seal). Denne baserte seg på sure monomerer som var i stand til å etse og binde seg på molekylært nivå i tannsubstans. Problemet med Haggers bonding var en sterk krympning, både av bondingen og fyllingsmaterialet. Teknologien var ikke kommet langt ennå. I 1955 oppdager Michael Buonocore [1] effekten av å syreetse emalje for å bedre feste resinbaserte materialer til tannsubstans. Med en kraftig forbedring av komposittene ved innføring av bisphenol A-glycidyl methacrylate (Bis-GMA; Bowens resin) [2] tidlig på 1960-tallet, begynte kompositt-teknologien å skyte fart. Behovet for en bedre metode for å «lime» kompositt til tannsubstansen, ledet til utviklingen av eget bonding-steg. Bondingen/adhesivet måtte være tyntflytende for å oppnå god nok kontakt til tannvev (kort avstand mellom materialet og underlaget) slik at adhesjonsmekanismer skulle kunne virke. Det er gjort store fremskritt innen adhesiv tannbehandling fra «første generasjons system» til dagens behandlingsmetoder som spenner fra den såkalte fjerde- til niende generasjons adhesivsystemer. De forskjellige «generasjonene» beskriver utvikling over tid der målet har vært å forbedre bindingsstyrken, forenkle påføringsprosedyrer og forbedre kliniske resultater [3]. I moderne tannbehandling står adhesive teknikker helt sentralt, og disse benyttes i et bredt spekter av behandlingsmetoder. Adhesiv-systemer anvendes både til direkte- og indirekte restaureringer og av og til som forseglingsmateriale. De gir en god binding mellom de harde tannvev og tannrestaureringsmaterialer. Mere utfyllende om systemene og deres bruk i klinikken finnes beskrevet i annen artikkel i denne temautgaven av Tidende/Tandlægebladet (Torgils Lægreid med medforfattere).
Grunnleggende prinsipp for adhesivsystemene er tredelt (gjelder fra 4. generasjon selv om steg kan være sammenslått til en klinisk prosedyre i senere generasjoner).
– Første steg er «kondisjonering» av overflaten til den del av tannen (dentin/emalje) som er aktuell dvs. hardvevet forbehandles med syre-etsing. Syren fjerner mineraler fra overflaten slik at det dannes et dypere relief/øket areal hvor monomerene kan flyte inn og herdes/binde til hardvevsoverflaten. Videre er formålet med dette trinnet å rengjøre overflaten, fjerne løst organisk materiale (smear-layer) og ikke minst øke overflateenergien (-spenningen) slik at primeren kan flyte ut over (fukte) hele det tilgjengelige arealet.
– Det andre steget er å påføre en hydrofil primer. Overflateenergien til primeren er nokså lik overflateenergien til tannoverflaten etter ets med syre. Dette gjør at primeren kan flyte lett utover den etsede tannflaten og fukte hele flaten. Den trenger også dypere ned i det fuktige tannvevet fordi den har hydrofile egenskaper (dvs. den fungerer i fuktig miljø).
– Det tredje steget er å påføre selve adhesivet. Dette gjøres etter at primeren har fått tid til å virke og løsemidlet er fordampet etter lett luftblåsing. Selve adhesivet er hydrofobt dvs. det blander seg ikke med vann. Et viktig poeng er at primeren er såkalt amfifil, som betyr at det er både hydrofilt og hydrofobt. Primerens hydrofile egenskaper gjør at den kan trenge inn i tannstrukturen (fuktig), mens den hydrofobe delen vil binde seg til hydrofobe molekyler i adhesivet. Etter luftblåsing for å gjøre adhesivsjiktet så tynt som mulig, lysherdes primer og adhesiv i ett. Nå vil den hydrofobe overflaten på adhesivet kunne binde seg til de hydrofobe monomerene i kompositt og resinsementer.
Påføringsprosessen for adhesivsystemene kan som forklart over, skje i tre separate kliniske steg eller kombinasjoner som gir ett eller to kliniske steg. I stedet for den nevnte inndeling i «generasjoner» så har det blitt mer vanlig å klassifisere adhesivesystemene ut fra antall kliniske steg. En vanlig inndeling er ets og skyll adhesivsystemer (2- og 3-trinns), selvetsende adhesivsystemer (1- og 2-trinns) og universal-adhesivsystemer (som oftest ett trinns). De såkalte 3-trinns ets og skyll produktene refererer til ets med syre, primer og adhesivpåføring. Etseprosedyren regnes som eget trinn. I dag anbefales alltid etsing av emalje og av enkelte også kort etsing av dentin (maks 5 sekunder) for å fjerne smearlayer, rense overflaten og øke overflateenergien. Etsing blir derfor å regne som eget trinn uansett adhesivsystem. Slik sett blir også universaladhesivsystemene å regne for 2-trinns systemer. Prinsippet for selve adhesjonen for alle er en kombinasjon av mikromekanisk og kjemisk binding.
Tross tilsynelatende enkle prinsipp, så er det et stort utvalg av forskjellige adhesivprodukter tilgjengelig på det europeiske markedet. De mange produsenter av adhesivsystemer har hver et utvalg som kan variere fra 3-stegs ets og skyll systemer til universal-systemer. Basert på dette så sier det seg selv at adhesiver er en lite homogen materialgruppe vurdert med hensyn til deres kjemiske sammensetning. Ut fra en generell betraktning så ligger det i adhesivenes natur, som innebærer både etsing og høy reaktivitet (monomerer som skal binde og polymerisere), et potensial til å påvirke levende celler og vev i eksponerte individer. For å best mulig forstå dette skadepotensialet som ligger i materialene, er det derfor viktig å være klar over innholdsstoffer og eksponeringsrisiko for både pasient og tannhelsepersonell. Med god kunnskap om dette, så har man også et godt verktøy for en trygg bruk ved å minimalisere eksponeringen og dermed faren for skadelige effekter.
Innholdsstoffer i adhesivsystemer
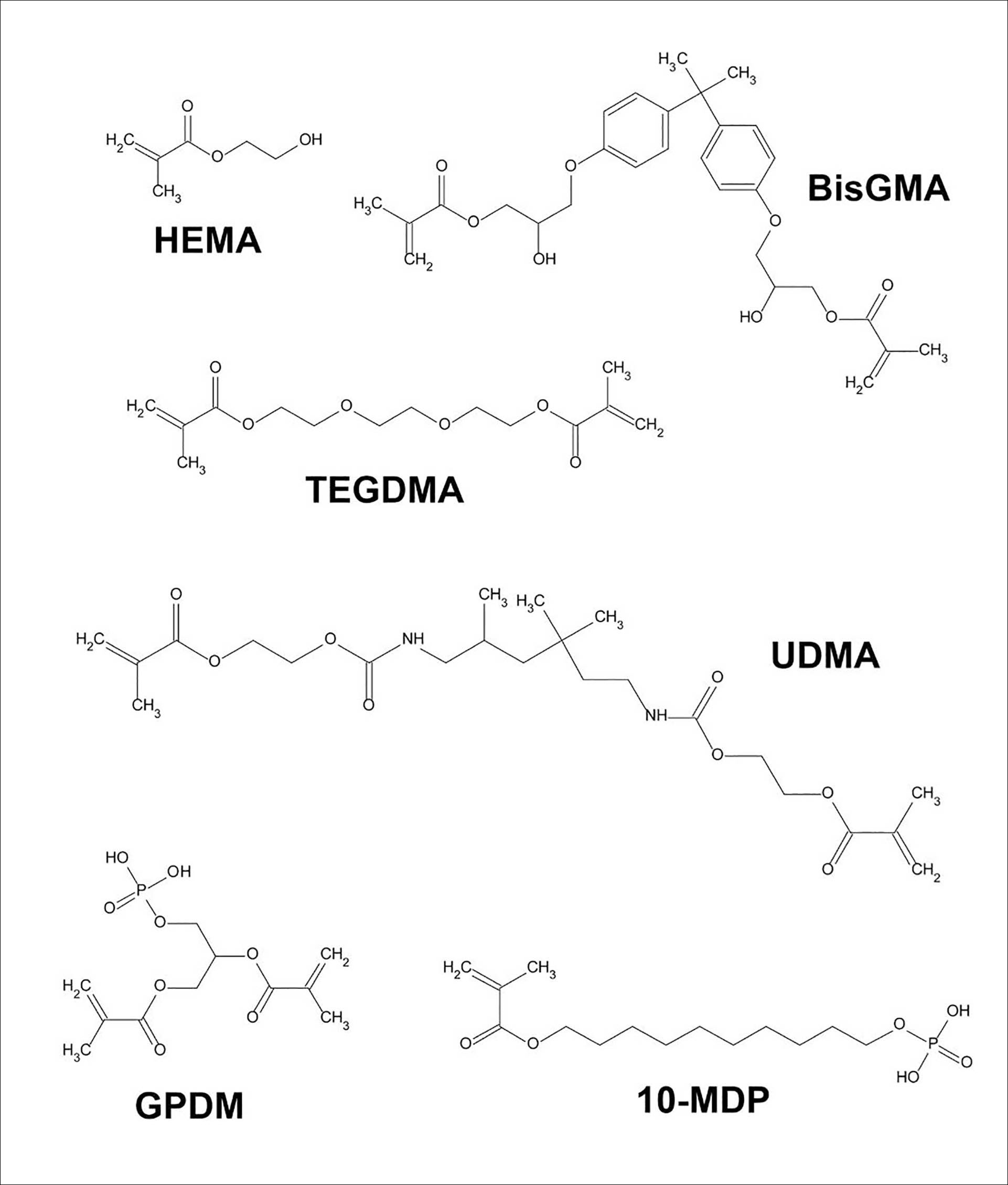
Figur 1. Kjemiske strukturer. Figuren viser stukturformel for vanlige monomerer i dentale adhesivsystemer. Den hydrofile monometakrylaten HEMA er vanlig for priming av emalje og dentin. De lipofile dimetakrylatene BisGMA, TEGDMA og UDMA er vanlige komponenter i adhesivresinen mens glycero-phosphate dimethacrylate (GPDM) og 10-Methacryloyloxydecyl dihydrogen phosphate (10-MDP) er metakrylater funksjonalisert med en «sur» fosfatgruppe.
Fra hovedfunksjonene i adhesivsystemer kan disse som nevnt deles inn i et etsemiddel, en primer og et adhesivresin. Etsemiddelet i ets og skyll systemer er som regel 35-37% fosforsyre. Primeren er sammensatt av hydrofile monomerer (for eksempel 2-Hydroksyetylmetakrylat (HEMA)), vanligvis i et hydrofilt løsningsmiddel som aceton, etanol eller vann. I selvetsende adhesivsystemer brukes det monomerer som er syrefunksjonalisert som regel med en eller flere fosfatgrupper. Adhesivet danner bindingen mellom preparert hard tannsubstans og for eksempel resinmatrisen i en kompositt. Adhesivet er vanligvis en blanding av dimetakrylat monomerer som for eksempel bisphenol A-glycidyl methacrylate (Bis-GMA), etoksylert bisfenol-A dimetakrylat (Bis-EMA) og trietyleneglykol dimetakrylat (TEGDMA). Tabell 1 viser de prinsipielle kjemikaliegruppene og deres funksjon i forskjellige adhesivsystemer. Figur 1 viser strukturformel av vanlige monomerer som benyttes i adhesivsystemene. I tillegg inneholder adhesivsystemene et initiatorsystem og i noen tilfeller uorganiske fyllpartikler [4].
Type |
Innholdsoffer |
Innholdsstoffers funksjon |
|---|---|---|
Ets og skyll (2 og 3 trinns) |
35% H3PO4 |
Etsing av emalje og dentin |
|
Hydrofil monomer (For eksempel HEMA) |
Priming av emalje og dentin |
|
Hydrofobe monomerer (for eksempel TEGDMA og BisGMA) |
Adhesivresin |
|
Selvetsende (1-2 trinn) |
Syremodifiserte monomerer (fosfat-funksjonaliserte monomerer som for eksempel 10-Methacryloyloxydecyl dihydrogen phosphate (10-MDP)) Kan også inneholde andre hydrofile monomer som HEMA |
Etsing og priming av emalje og dentin |
Hydrofobe monomerer (for eksempel TEGDMA og BisGMA) |
Adhesivresin |
|
Universal (1 trinn)* |
Ligner 1-trinns selvetsende |
Etsing og priming av emalje og dentin |
|
karboksylat og/eller fosfat monomerer (for eksempel 10-MDP og 4-[2-(methacryloyloxy)ethoxycarbonyl]-phthalic acid (4-MET)) |
Biinder ionisk til kalsium i hydroksyapatitt |
* Disse benevnes oftest som 1-trinns, men blir også omtalt som 2-trinns da det oftest benyttes et etse-trinn før påføring (jfr. 3-trinns ets og skyll).
Biologiske effekter av innholdsstoffer
Blant monomerene som brukes i adhesivsystemer er 2-hydroxyethylmethakrylat (HEMA) den man kjenner best. Monomeren er en hovedbestanddel i mange adhesivsystemer og det foreligger et stort antall forskningsartikler om dens effekter på levende celler. HEMA har lav molekylvekt (130 Da) og er en såkalt amfifil monomer. Som nevnt i innledningen gjør dette at den både kan binde til hydrofilt dentin og emalje og samtidig til hydrofobe monomerer i adhesivresinet. Disse egenskapen gjør HEMA til den i særklasse mest brukte primer og er en av hovedbestanddelene i de fleste adhesivsystemer, både selvetsende og ets-og-skyll adhesiver. Disse egenskapene gjør også at ikke-bundet monomer lettere kan lekke ut under og etter behandling og lett tas opp i levende celler [5].
Fra klinisk erfaring kjenner man godt til HEMA sitt potensial til å utløse kontaktdermatitt etter direkte kontakt med hud [6]. Slike reaksjoner kan være av irritativ eller allergisk natur [7]. Funn tyder videre på at det er vanlig med kryss-reaktivitet mellom akrylat-monomerer slik at individer sensibilisert for en monomer kan bli multi-allergske, og dermed ikke bør eksponeres for noen akrylatmonomerer [8].
Hovedtyngden av cellekulturstudier er utført med monomerer som til en viss grad er vannløselige, og dermed også løselige i cellekulturmedium. Mye av dagens kunnskap om metakrylater er derfor basert på studier av metakrylater som HEMA, metylmethacrylat (MMA) og TEGDMA. Resultatene tyder på at den elektrofile metakrylatgruppen som reagerer ved polymerisering også er den som gir opphav til toksisitet [9]. Ut fra en slik hypotese kan man anta at mange observasjoner gjort med enkelte metakrylater er overførbare til andre metakrylater, på lik linje med kryss-reaktivitet mellom akrylat-monomerer og sensibilisering beskrevet over. Eksponeringsdose og metakrylatgruppens reaktivitet (sterk til svak elektrofil; påvirkes av hele molekylstrukturen) [10] [11] vil da være det avgjørende for utvikling av ovennevnte uønskede biologiske effekter.
I tråd med kliniske observasjoner av kontaktdermatitt ser mange metakrylat-monomerer ut til å kunne binde til cystein [9]. Cystein er en nukleofil aminosyre som finnes i de fleste proteiner i tillegg til tripeptidet glutathion (GSH). Binding av metakrylater til kroppens egne proteiner via cystein kan medføre konformasjonsendringer i proteinene som igjen gir opphav til kontaktallergi. En reaksjonsmekanisme via slike hapten-modifiserte proteiner er godt kjent fra andre elektrofile forbindelser [12]. Forutsatt en slik mekanisme så kan laboratoriestudier tolkes som at for eksempel TEGDMA er langt mer potent når det gjelder å gi kontaktallergi enn monomeren HEMA [9].
Den elektrofile egenskapen til metakrylat-monomerene som er nødvendig for god polymerisering, er vist å kunne aktivere forsvarsmekanismene i celler [13] [14]. HEMA er vist å forstyrre redoks-balansen i eksponerte celler slik at forsvaret mot oksidativt stress styrkes og autofagikapasiteten øker. Oksidativt stress er en tilstand der prooksidanter dominerer over antioksidanter. Dette kan ha negative effekter på molekyler som for eksempel proteiner, lipider og DNA. Autofagi er prosessen som fjerner defekte molekyler og organeller i cellene. Andre studier tyder på at metakrylateksponering kan påvirke syntesen av betennelsesmediatorer [15]. Hvilken betydning slike effekter har på eksponerte individer er ikke klart, men det er nærliggende å tenke at det kan påvirke celler evne til å håndtere for eksempel bakterie infeksjoner. Da vil både riktig signalisering via betennelsesmediatorer og et tilgjengelig/velfungerende «autofagi-maskineri» være viktig. Generell cytotoksisitet [16], nedgang i GSH-nivå [17] og endringer i cellevekst [18] er andre funn som er rapportert i metakrylat-eksponerte celler.
En ulempe med HEMA er at den rapporteres å fremme vannopptak som kan føre til hydrolyse av bindinger mellom materiale og tann og redusere festet over tid [19]. Med dette og HEMA sitt velkjente allergipotensial som bakgrunn har det vært eksperimentert med akrylamidbaserte monomerer som et alternativ. I forhold til biologiske effekter og eksponeringssituasjonen er det imidlertid lite data tilgjengelig, men alternativene er også er elektrofile forbindelser som vil kunne interagere med celler på en uheldig måte. Nøyaktig beskrivelse av disse akrylamidbaserte forbindelsene er heller ikke alltid oppgitt fra produsenten av adhesivsystemet. Dermed er det vanskelig å vurdere det toksiske potensialet.
Andre metakrylatmonomerer som ofte er oppgitte innholdsstoffer er BisGMA og UDMA. Det foreligger langt mindre kunnskap om effekt av disse på levende celler, men fra hypotesen om at metakrylatgrupper generelt gir samme reaktivitet så kan effekter som er observert for andre metakrylater forventes. Stor forskjell i vann- og fettløselighet kan imidlertid gi stor forskjell i hvilke subcellulære områder molekylene vil kunne påvirke. Andre reaktive grupper i molekylene, som for eksempel karboksylat og fosfat i sure monomerer, vil også kunne påvirke en toksisk respons.
BisGMA syntetiseres med utgangspunkt i Bisfenol-A (BPA). På bakgrunn av dette har det vært bekymring knyttet til mulig forurensing i og utlekk av hormonhermeren BPA fra resinbaserte tannmaterialer som inneholder BisGMA. I en studie fra 2018 bekreftes det at BPA kan lekke fra slike materialer, men det konkluderes også med at BPA utlekket gir et nær ubetydelig bidrag i forhold til den totale BPA-dosen man normalt utsettes for. Bidraget fra denne eksponeringen synes derfor ikke å ha betydning for uønskede helseeffekter relatert til BPA-eksponering [20]
Det er som nevnt lite kunnskap om toksisitet av de mange syre-funksjonaliserte monomerene som brukes i selvetsende- og universal-adhesiver. Det finnes laboratoriestudier som viser celledød, cellevekstendringer, DNA-skade i celler eksponert for ekstrakt fra forskjellige universaladhesiver etter herding [21]. Det er ikke gjort analyser av utlekk fra disse adhesivsystemene, så hvilke innholddsstoffer som er årsak til effektene er ikke kjent. Studien viser også stor variasjon mellom forskjellige produkters effekt på celler. Dette understreker kompleksiteten og variasjonsmuligheten i materialene. For å få bedre oversikt over det toksiske potensiale som ligger i disse materialene er det er behov for mere forskning. Kunnskap om sammensetning, enkeltmonomerers effekt på celler, utlekk fra materialene og materialegenskaper som for eksempel pH [22] er i dag mangelfullt når det gjelder selvetsende- og universal-adhesiver.
Eksponering for adhesivsystemenes komponenter i klinikken
Uønskede biologiske effekter av adhesiver avhenger i tillegg til kjemikalienes direkte innvirkning på celler og vev (toksikodynamikken), av eksponeringsdose og eksponeringsvei (toksikokinetikk). Fravær av eksponering gir naturligvis ingen toksisk effekt. Å holde eksponeringen på lavest mulig nivå vil derfor alltid være en god strategi for å unngå uønskede biologiske effekter. Med dette som utgangspunkt, vil operatørens teknikk kunne ha stor betydning for å redusere faren for uønskede effekter både for pasient og tannhelsepersonell.
Etsing med forforsyre i dype, pulpanære kaviteter (restdentintykkelse < 0,5mm) kan potensielt skade pulpavevet. Avstand til pulpa er en vanskelig vurdering og teknikker som innebærer selektiv fjerning av kariøst dentin [23] [24] kan være svært nyttig for å unngå skade på pulpa. Diffusjon gjennom dentin vil i tillegg til dentintykkelse avhenge av tid som syren ligger på og styrken. Dermed vil skylling etter etsing også kunne være av betydning for å redusere eventuell skade. Selektiv ets er en måte å redusere syrepåvirkningen i dype kaviteter ved at emaljekanten først eksponeres for syren (10-15 sekunder) før hele kaviteten fylles med etse-gel som skylles bort etter maksimalt 5 sekunder. Produsenter av adhesiver anbefaler vanligvis at man skyller like lenge som syren har ligget på tannsubstansen (5-15 sekunder). For trygg bruk generelt må produsentenes anvisninger for materialene følges.
Laboratoriestudier har vist at HEMA kan diffundere gjennom dentin relativt raskt [25]. Eksponering av pulpavev hos pasient er derfor viktig å være oppmerksom på. Etter herding er det naturligvis bare restmonomer som vil kunne diffundere, så god herding vil redusere denne eksponeringen. En fordel som nevnes ved 3 stegs ets-og-skyll er at man ved tørrblåsing har bedre kontroll på fjerning av overskudd av primer og løsemiddel. Analyser av pasienters saliva etter behandling viser også målbare konsentrasjoner av HEMA [26]. Primer applisert utenfor aktuelt område eller lekkasje av ikke-herdet monomer kan være årsak til dette. Nøyaktighet ved påføring og god herding av adhesivet vil kunne begrense eksponering av munnslimhinner/gingiva. Bruk av kofferdam vil også kunne begrense utilsiktet eksponering av slimhinner ved påføring.
At HEMA og andre metakrylater kan gi kontaktdermatitt etter direkte hudkontakt er tidligere nevnt [8]. Fokus på«no-touch» teknikk for de som håndterer materialene gir redusert hudeksponering og dermed redusert fare for sensibilisering. Her er det også viktig å være oppmerksom på at de fleste hansker kun gir begrenset beskyttelse [27].
I tillegg til de nevnte eksponeringsveiene er det registrert HEMA i luften på tannklinikker [28] [29]. HEMA er relativt flyktig og kan til en viss grad dampe av fra primer ved tørrblåsing (fjerne løsemidler; etter primer og etter adhesiv før lysherding). Selv om luftkonsentrasjonene er relativt lave så vil en eksponering av tannhelsepersonells luftveier kunne ha betydning da de oppholder seg i lokalene daglig og vil eksponeres over lang tid. Bruk av vakum-sug ved tørr-blåsingen og god ventilasjon i lokalene, kan redusere denne eksponeringen.
Selvetsende adhesivesystemer inneholder monomerer som er substituert med en eller flere fosfat- eller karboxylatgrupper (sure monomerer). 10-Methacryloyloxydecyl dihydrogen phosphate (10-MDP) og glycero-phosphate dimethacrylate (GPDM) er to vanlige sure monomerer i selvetsende adhesivesystemer. I likhet med de akrylamidbaserte monomerene så foreligger det lite data på eksponering for disse monomerene. Adhesivsystemer som bruker disse monomerene inneholder i hovedsak også HEMA, de er altså ikke HEMA-frie.
Mange adhesivresinmonomerer som for eksempel TEGDMA, BisGMA og UDMA er større, mindre vannløselige og mindre flyktige molekyler sammenlignet med HEMA. Dette betyr at det må forventes lavere eksponering av pulpa, oral slimhinne og luftveier sammenlignet med HEMA. Eksponering ved direkte kontakt påvirkes imidlertid ikke av disse faktorene, og i laboratoriestudier synes flere av disse å være mer toksiske enn HEMA. Direkte hudkontakt bør derfor unngås. Ved søl på hansker bør de raskt skiftes.
I tillegg til alle kjente innholdsstoffer i de omtalte materialene kan kjemikalier som bare finnes i mindre mengder være til stede uten at de er beskrevet i sikkerhetsdatabladet. For eksempel må CRM (kreftfremkallende, reproduksjonstoksisk og mutagent) i kategori 1 eller 2 bare deklareres når innholdet er over 0,1 vektprosent. For innholdsstoffer som er etsende eller irriterende, er grensen 1 vektprosent [30] [31]. Noen kjemikalier kan også være bare delvis beskrevet i sikkerhetsdatabladet for produktet eller omtalt som «hemmelig». Om det for eksempel oppstår allergisituasjoner og man mistenker dentalprodukt som årsak kan det derfor være nødvendig med henvendelse til produsent (ev. via importør) for å avdekke andre innholdsstoffer enn de som er oppgitt i sikkerhetsdatabladet. Generelt bør tannlegen følge bruksanvisningene og ta sikkerhetsadvarsler angående farlige substanser på alvor.
Oppsummering/konklusjon
Dentale adhesivsystemer ble introdusert for mer enn 70 år siden og har gjennomgått en omfattende utvikling. I moderne tannbehandling står adhesive teknikker helt sentralt, og materialene benyttes i et bredt spekter av behandlingsmetoder. Adhesivsystemer er en gruppe av svært komplekse materialer med stor variasjon på innholdsstoffer. Mange av innholdsstoffene har et tydelig potensial til å skade celler og vev. Allergiske reaksjoner er blant de vanligst rapporterte., Med god kunnskap om innholdsstoffenes toksisitet og håndtering med fokus på å begrense eksponering av pasient og tannhelsepersonell, er det liten fare for skadelige effekter.
Referanser
Buonocore MG. A simple method of increasing the adhesion of acrylic filling materials to enamel surfaces. J Dent Res. 1955;34(6):849-53.
Bowen RL. Properties of a silica-reinforced polymer for dental restorations. J Am Dent Assoc. 1963;66:57-64.
Van Meerbeek B, Yoshihara K, Yoshida Y, et al. State of the art of self-etch adhesives. Dent Mater. 2011;27(1):17-28.
Van Landuyt KL, Snauwaert J, De Munck J, et al. Systematic review of the chemical composition of contemporary dental adhesives. Biomaterials. 2007;28(26):3757-85.
Schmalz G. Resin-Based Composites. In: Schmalz G, Arenholt-Bindslev D, editors. Biocompatibility of Dental Materials. 1 ed: Springer Berlin Heidelberg; 2009. p. 99-137.
Aalto-Korte K, Alanko K, Kuuliala O, et al. Methacrylate and acrylate allergy in dental personnel. Contact Dermatitis. 2007;57(5):324-30.
Tang AT, Björkman L, Ekstrand J. New filling materials--an occupational health hazard. Ann R Australas Coll Dent Surg. 2000;15:102-5.
Kanerva L. Cross-reactions of multifunctional methacrylates and acrylates. Acta Odontol Scand. 2001;59(5):320-9.
Ansteinsson V, Kopperud HB, Morisbak E, et al. Cell toxicity of methacrylate monomers-the role of glutathione adduct formation. J Biomed Mater Res A. 2013;101(12):3504-10.
Chipinda I, Ajibola RO, Morakinyo MK, et al. Rapid and simple kinetics screening assay for electrophilic dermal sensitizers using nitrobenzenethiol. Chem Res Toxicol. 2010;23(5):918-25.
Klaassen CD. Casarett & Doull’s toxicology : the basic science of poisons. 7th ed. New York: McGraw-Hill Medical; 2008.
Chipinda I, Hettick JM, Siegel PD. Haptenation: chemical reactivity and protein binding. J Allergy (Cairo). 2011;2011:839682.
Becher R, Valen H, Olderbø BP, et al. The dental monomer 2-hydroxyethyl methacrylate (HEMA) causes transcriptionally regulated adaptation partially initiated by electrophilic stress. Dent Mater. 2019;35(1):125-34.
Samuelsen JT, Michelsen VB, Bruun JA, et al. The dental monomer HEMA causes proteome changes in human THP-1 monocytes. J Biomed Mater Res A. 2019;107(4):851-9.
Bolling AK, Samuelsen JT, Morisbak E, et al. Dental monomers inhibit LPS-induced cytokine release from the macrophage cell line RAW264.7. Toxicol Lett. 2013;216(2-3):130-8.
Spagnuolo G, D’Anto V, Valletta R, et al. Effect of 2-hydroxyethyl methacrylate on human pulp cell survival pathways ERK and AKT. J Endod. 2008;34(6):684-8.
Volk J, Leyhausen G, Geurtsen W. Glutathione level and genotoxicity in human oral keratinocytes exposed to TEGDMA. J Biomed Mater Res B Appl Biomater. 2012;100(2):391-9.
Schweikl H, Altmannberger I, Hanser N, et al. The effect of triethylene glycol dimethacrylate on the cell cycle of mammalian cells. Biomaterials. 2005;26(19):4111-8.
Takahashi M, Nakajima M, Hosaka K, et al. Long-term evaluation of water sorption and ultimate tensile strength of HEMA-containing/-free one-step self-etch adhesives. J Dent. 2011;39(7):506-12.
Becher R, Wellendorf H, Sakhi AK, et al. Presence and leaching of bisphenol a (BPA) from dental materials. Acta Biomater Odontol Scand. 2018;4(1):56-62.
Wawrzynkiewicz A, Rozpedek-Kaminska W, Galita G, et al. The Toxicity of Universal Dental Adhesives: An In Vitro Study. Polymers (Basel). 2021;13(16).
Staxrud F, Valen H. Potential of <<universal>> bonding agents for composite repair. Biomater Investig Dent. 2022;9(1):41-6.
Bjørndal L. Stepwise Excavation. Monogr Oral Sci. 2018;27:68-81.
European Society of Endodontology developed b, Duncan HF, Galler KM, et al. European Society of Endodontology position statement: Management of deep caries and the exposed pulp. Int Endod J. 2019;52(7):923-34.
Bouillaguet S, Wataha JC, Hanks CT, et al. In vitro cytotoxicity and dentin permeability of HEMA. J Endod. 1996;22(5):244-8.
Michelsen VB, Kopperud HB, Lygre GB, et al. Detection and quantification of monomers in unstimulated whole saliva after treatment with resin-based composite fillings in vivo. Eur J Oral Sci. 2012;120(1):89-95.
Andreasson H, Boman A, Johnsson S, et al. On permeability of methyl methacrylate, 2-hydroxyethyl methacrylate and triethyleneglycol dimethacrylate through protective gloves in dentistry. Eur J Oral Sci. 2003;111(6):529-35.
Henriks-Eckerman ML, Alanko K, Jolanki R, et al. Exposure to airborne methacrylates and natural rubber latex allergens in dental clinics. JEnvironMonit. 2001;3(3):302-5.
Hagberg S, Ljungkvist G, Andreasson H, et al. Exposure to volatile methacrylates in dental personnel. J Occup Environ Hyg. 2005;2(6):302-6.
ECHA. Compilation of safety data sheets. In: Agency EC, editor. 2015.
Regulation (EU) 2017/745 of the European Parliament and of the Council of 5 April 2017 on medical devices, amending Directive 2001/83/EC, Regulation (EC) No 178/2002 and Regulation (EC) No 1223/2009 and repealing Council Directives 90/385/EEC and 93/42/EEC (Text with EEA relevance. ), 2017.
English summary
Biological effects of dental adhesive systems
The development of dental adhesive systems started more than 70 years ago but first became common in the 80s. In modern operative dentistry, adhesive techniques are central, and the materials are used in a wide range of treatment methods. Adhesive systems are a group of very complex materials with great variation in chemical composition, and method of use.
The systems used today are relatively easy to use, but one must be aware that many ingredients, such as acids and monomers, have a general toxic potential and may induce allergic disease. To best understand the adverse effect potential of the materials, it is therefore vital to be aware of the ingredients and exposure risks for patients and dental health personnel. With good knowledge of this, you also have a good tool to minimize exposure and thus the risk of harmful effects.
Samuelsen JT, Dahl JE, Staxrud F. Biologiske effekter av dentale adhesivsystemer. Nor Tannlegeforen Tid. 2024;134:598-603. doi:10.56373/2024-8-5
Korresponderende forfatter: Jan T. Samuelsen. NIOM, Sognsveien 70 A, 0855 Oslo; E-post: j.t.samuelsen@niom.no
Akseptert for publisering, 29. januar 2024.
Artikkelen er fagfellevurdert
Artikkelen siteres som: Samuelsen JT, Dahl JE, Staxrud F. Biologiske effekter av dentale adhesivsystemer. Nor Tannlegeforen Tid. 2024; 134: 598-603.
MeSH: Dental adhesive; Methacrylates; Biocompatible Materials; Hypersensitivity
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Samuelsen JT, Dahl JE, Staxrud F. Biologiske effekter av dentale adhesivsystemer. Nor Tannlegeforen Tid. 2024;134:598-603. doi:10.56373/2024-8-5
