Biofilmkontrol ved behandling af parodontitis
Klinisk relevans
Parodontitis, som er en af de mest udbredte ikkeoverførbare sygdomme, er forårsaget af bakteriel biofilm. Nøgleordet i forbindelse med forebyggelse og behandling af parodontitis er derfor biofilmkontrol. Denne artikel diskuterer de kliniske tiltag, man som tandlæge bør overveje, når man tilbyder evidensbaseret behandling.
Parodontitis er en af de mest udbredte ikkeoverførbare sygdomme blandt voksne. Selvom parodontitis betragtes som en multifaktoriel inflammatorisk sygdom, er den primære årsag til parodontitis en dysbiotisk bakteriel biofilm, som medfører et uhensigtsmæssigt værtsrespons. Kontrol med biofilmen er derfor det primære formål ved såvel forebyggelse (herunder primordial, primær og sekundær profylakse) som behandling. Denne artikel diskuterer forskellige tilgange til klinisk håndtering og refererer den retningslinje, som European Federation of Periodontology har udarbejdet. Vi fremlægger endvidere den aktuelle opfattelse af, hvordan biofilmkontrol påvirker bakteriel dysbiose, og vurderer den potentielle rolle for systemiske antibiotika og «endemålstest»af bakterielle biofilm.
De kliniske retningslinjer for forebyggelse og behandling af parodontitis i stadie 1-3, som European Federation of Periodontology (EFP) har udarbejdet, hviler i høj grad på princippet om biofilmkontrol [1]. Årsagssammenhængen mellem bakterier og gingival inflammation er blevet påvist i klassiske studier [2], og det samme gælder den gavnlige virkning af tiltag, som fokuserer på fjernelse af biofilm [3] [4]. De antiinfektiøse behandlingstiltag i disse grundlæggende publikationer var baseret på, at patienterne selv holdt biofilmen under kontrol gennem regelmæssige mundhygiejnevaner, samt på professionel mekanisk fjernelse af supra- og subgingivale belægninger (første og andet trin i parodontalbehandling) [1].
Det er gentagne gange blevet vist, at fuldstændig fjernelse af plak på rodoverflader ikke kan forventes, end ikke hvis behandlingen foretages af fagpersoner på specialistniveau [5] [6] [7] [8]. Dette forhindrer imidlertid ikke, at der klinisk ofte/typisk kan konstateres ophævelse af inflammation [9]. Nyere studier over forskellige indfaldsvinkler til den initiale, non-kirurgiske parodontalterapi understøtter yderligere den opfattelse, at reduktion af biofilmmængden til et niveau under den enkelte patients tærskelværdi (dvs. biofilmen forsvinder ikke, men holdes under kontrol) er et tilfredsstillende klinisk behandlingsmål [10] [11]. Et centralt led i denne «styrede tilgang»er, at der på et tidligt tidspunkt etableres regelmæssige mundhygiejnevaner, og at der som følge heraf sker en reduktion af den inflammation, som er en nøglespiller i den mikrobielle dysbiose [12] [13] og bidrager til det subgingivale mikrobioms ernæring [14]. Formålet med denne oversigtsartikel er at sætte fokus på de aspekter af biofilmkontrol, som er relevante for behandlingen af parodontitis.
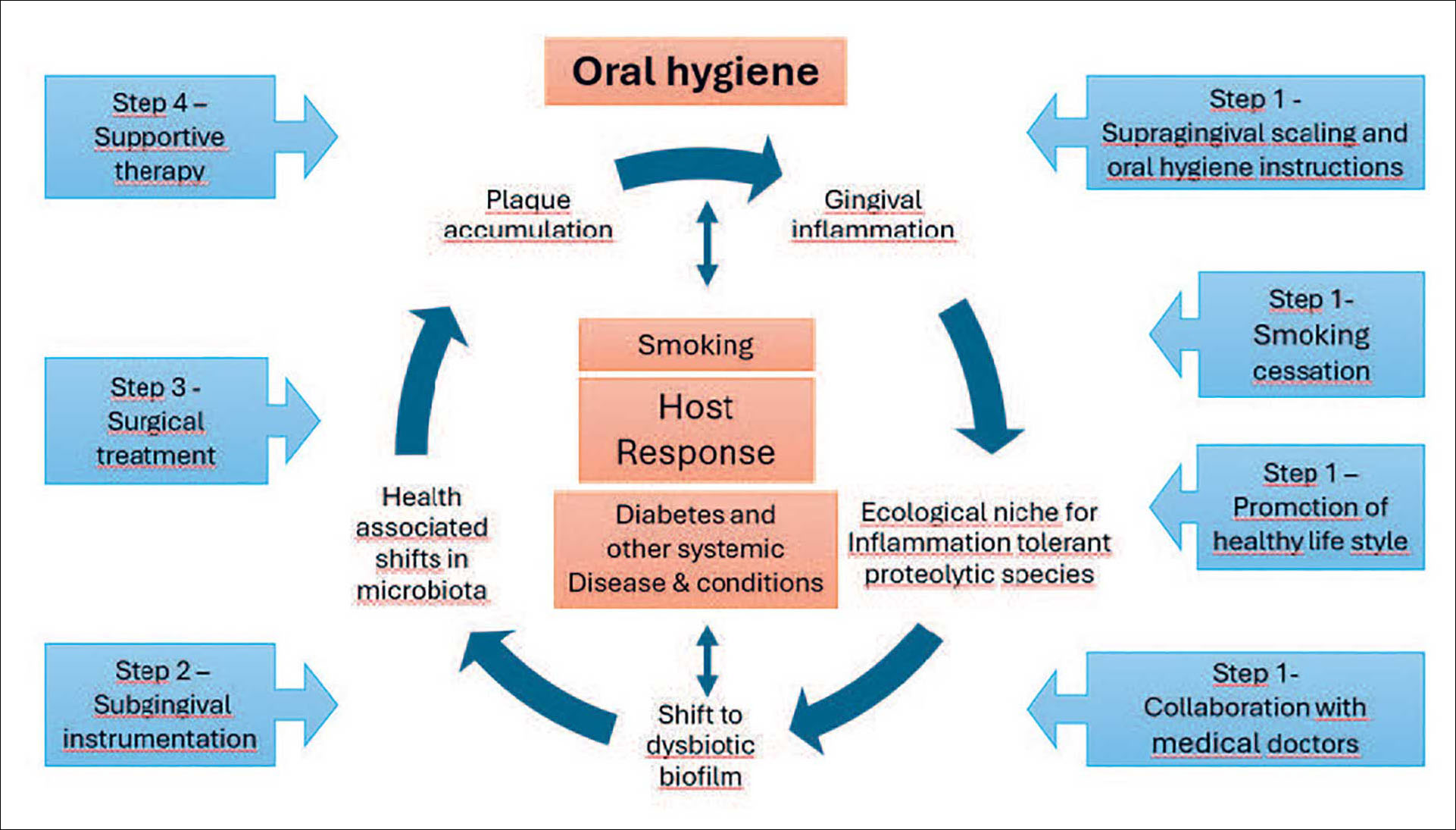
Figur 1. Skematisk illustration af samspillet mellem dårlig mundhygiejne, værtssvar og terapeutiske tiltag på udviklingen af subgingival biofilm (modificeret efter Rosier et al. (2017). Dårlig mundhygiejne og plakophobning er de drivende kræfter i et sygdomsfremkaldende skift i retning af en parodontitisassocieret dysbiotisk biofilm hos en modtagelig vært. Trinvise indgreb har til formål at kontrollere biofilmen på såvel tand- som patientniveau. En vellykket behandling beror på et gavnligt skift i retning af sunde forhold.
Kliniske værktøjer til biofilmkontrol
Behandlingen af parodontitis i stadie 1-3 falder i tre trin. Første trin indebærer etablering af en sufficient mundhygiejne, professionel fjernelse af supragingival plak og calculus samt en indsats over for risikofaktorer (fx rygestop). Andet trin er viet til subgingival instrumentering af fordybede inflammerede pocher. Efter denne nonkirurgiske behandling og en passende helingsperiode skal behandlingsresponset vurderes, og der skal tages stilling til eventuelt behov for et tredje trin i form af kirurgisk parodontalbehandling.
Fælles for alle disse behandlingstrin er, at det terapeutiske mål er biofilmkontrol. Selvom der aktuelt ikke findes validerede biofilmrelaterede udfaldsmål (se nedenfor), giver den trinvise tilgang klinikeren mulighed for at iværksætte de nødvendige behandlinger og undgå overbehandling. Det er veldokumenteret, at områder med inflammation og kun let fordybede pocher kan holdes i ave med omhyggelig mundhygiejne, dvs. trin 1-terapi [15] [16]. Det vigtigste redskab til approksimal rengøring er interdentalbørster, mens såvel manuelle som elektriske tandbørster kan anbefales til plakfjernelse på de øvrige tandflader [1]. Studier tyder på, at elektriske tandbørster fjerner plakken mere effektivt på voksenbefolkningen som helhed [17], mens de tilsyneladende ikke er bedre end manuelle børster, når det drejer sig om patienter, der har gennemgået en grundig parodontalbehandling.
Trin 1-terapi har ikke kun effekt på biofilmen koronalt for margo gingivae. Der er også i flere studier påvist en reduktion i forekomsten af parodontitisassocierede bakterier subgingivalt [15] [16]. Man formoder, at supragingival biofilmkontrol og fravær af marginal inflammation skaber en økologisk niche, som ikke er gunstig for parodontitisassocieret biofilm. Dette sker ved at mindske mængden af gingivalvæske og dermed adgangen til næringsstoffer samt ved at øge iltkoncentrationen [18]. Mere invasive behandlingstyper som fx subgingival instrumentering (trin 2) eller lapoperation (trin 3) reserveres typisk til initialt dybere pocher.
Eftersom parodontal inflammation hænger nøje sammen med en dysbiotisk parodontal biofilm [19] [20], synes det fornuftigt at rette sine kliniske tiltag imod infektionskontrol. Der er signifikant evidens for, at subgingival instrumentering yderligere mindsker den bakterielle belastning og det totale antal bakterier efter trin 1-terapi og desuden medvirker til at skabe en mere sund mikrobiota [21] [22] [23] [24] [25]. Det er tankevækkende, at den tid, der anvendes på subgingival instrumentering (trin 2), ifølge et nyere studie ikke er afgørende for det kliniske udfald, hvis der vel at mærke er etableret en sufficient og regelmæssig mundhygiejne (trin 1) [11]. Dette understreger betydningen af den inflammatoriske komponent og de økologiske forhold som ætiologiske faktorer ved parodontitis [26] [27] [28].
Effektiv kontrol med risikofaktorer (fx rygestop og glykæmisk kontrol ved diabetes) er også et vigtigt led i trin 1-terapi [29]. Rygning er en væsentlig risikofaktor for parodontitis og disponerer for en dysbiotisk biofilm med forøget forekomst af formodede patogener og forringet mikrobiologisk diversitet [30] [31]. Rygestop medfører gunstige ændringer i mikrobiotaen [32] [33] og i forekomsten af biomarkører for inflammation [34] [35], hvilket understreger vigtigheden af dette tiltag [1] [29]. Ligesom rygning har også diabetes og dårlig glykæmisk kontrol sammenhæng med forringede resultater af parodontalbehandling [36] [37]. Forhøjede glukosekoncentrationer i gingivalvæske og saliva bidrager til at skabe et miljø, der fremmer udvikling af en dysbiotisk biofilm. Dårlig glykæmisk kontrol medfører mundtørhed og forsuring af saliva, hvilket også kan påvirke sammensætningen af den subgingivale mikrobiota [38]. Der er imidlertid ikke mange studier, der har sammenlignet diabetikere og ikkediabetikere med hensyn til effekten af glykæmisk kontrol på mikrobiologiske ændringer efter nonkirurgisk behandling [39]. Ligesom rygere er diabetikere karakteriseret ved en formindsket diversitet i deres mikrobiota [31]. Efter behandling ses formindsket forekomst af parodontitisassocierede arter og en forøget forekomst af sundhedsassocierede arter samt en øget diversitet [38].
Det må formodes, at kirurgisk elimination af dybe restpocher og korrektion af det økologiske miljø vil resultere i en biofilm, der er forenelig med sundhed. Mens de kliniske resultater efter diverse kirurgiske indgreb er yderst veldokumenterede [1], er vores viden om ændringer i biofilmen meget begrænset. I en nyere systematisk oversigt over virkningerne af parodontalkirurgi på det subgingivale mikrobiom viste det sig, at der var så stor forskel på de metoder, der blev anvendt i de forskellige studier, at der ikke kunne drages definitive konklusioner [40]. Det forekommer dog sandsynligt, at den dysbiotiske biofilm vil blive genetableret, hvis der ikke er en tilfredsstillende og regelmæssig mundhygiejne i ugerne efter nonkirurgisk eller kirurgisk behandling, og dette understreger vigtigheden af god mundhygiejne [40] [41] [42] og professionelt styret vedligeholdelsesbehandling (trin 4) for opnåelse af et stabilt resultat over tid.
Den ovennævnte trinvise tilgang til behandling af parodontitis, som anbefales af EFP, opererer også med begrebet «endemål», dvs. en tærskelværdi, som kan signalere til klinikeren, at der ikke er behov for yderligere behandling. Den herskende tankegang er, at vævets homøostase kan genetableres, når inflammationen er klinget af [43] [44]. Dette kan være en forklaring på, hvorfor biofilmrelaterede endemål (dvs. mikrobiologisk test) ikke anbefales og rangeres lavere end mere direkte registrering af inflammation (fx blødning ved sondering, pochemål), når man vurderer de kliniske endemål og risikoen for fremtidig forværring af tilstanden [45]. Endvidere er nøjagtigheden af de kliniske markører til forudsigelse af fremtidig sygdomsudvikling større end ved mikrobiologisk test for plakpatogener [46] [47] [48].
Diagnostiske tests og antibiotika i biofilmkontrol
Diagnostiske tests for parodontale biofilm er typisk mikrobiologiske tests, der skal sendes til et laboratorium for nærmere analyse. Der er imidlertid nu fremkommet mikrobiologiske «point-of-care»(POC)-tests, som gør det muligt for klinikere og måske også patienter at få et svar i løbet af få minutter. Aktuelt har disse POC’er visse begrænsninger [49] [50], som muligvis vil blive overvundet hen ad vejen. Nogle POC’er kan anvendes til vurdering af antibiotikaresistens, inden man ordinerer antibiotika [51].
Mikrobiologisk test kan være relevant for patienter, der indgår i et klinisk studie, men bør ikke være en rutinebehandling i almen praksis. I flere lande [52] [53] har der kørt kampagner for at «gøre kloge valg», herunder undlade at anbefale unødvendige undersøgelser. Man bør altid før enhver test overveje muligheden for falsk negative/positive resultater samt huske vigtigheden af en tentativ diagnose. Klinikere bør altid tænke over, om en given diagnostisk test vil kunne ændre deres behandlingsvalg, inden de anbefaler den til deres patienter.
Den kliniske effekt af supplerende antibiotikabehandling i forbindelse med parodontalbehandling er blevet vurderet i talrige studier og systematiske oversigter. Den kliniske relevans af statistisk signifikante forskelle i pochedybde og fæsteniveau på < 0,5 mm, som nogle studier finder på den korte bane, har været ivrigt debatteret [54]. Fx konkluderede forfatterne til en nyere Cochrane-oversigt, at evidensgrundlaget for en eventuel effekt af systemisk antimikrobiel behandling ved nonkirurgisk parodontalbehandling er meget beskedent [55].
I overensstemmelse hermed indeholder EFP’s kliniske retningslinje følgende passus: «På grund af bekymring for patienternes sundhed og effekten af systemiske antibiotika på samfundsniveau kan rutinemæssig anvendelse af antibiotika som supplement til subgingival rensning hos patienter med parodontitis ikke anbefales». Det præciseres desuden, at antibiotikabehandling kun bør overvejes til specifikke patientkategorier [1]. Afgørende er risikoen for udvikling af resistente bakteriestammer, som stort set aldrig registreres i kliniske studier [55], men kan have meget alvorlige konsekvenser for patientens orale og generelle sundhed og for den generelle sundhed på samfundsniveau. I 2019 blev det i et grundigt og verdensomspændende studie anslået, at 1,27 millioner dødsfald skyldtes resistente stammer, hvilket understreger, at antibiotikaresistens er et væsentligt globalt sundhedsproblem [56]. Resistens skyldes overforbrug af antibiotika, og ifølge FDI bidrager tandlægerne også hertil [57]. Tandlæger bør derfor tage ansvar for udviklingen ved at orientere kolleger og patienter om bakteriel resistens og optimere deres anvendelse af antibiotika. Hvis systemiske antibiotika skal indgå i behandling af parodontitis, skal de betragtes som et supplement. Et vedvarende højt niveau af hjemmetandpleje og omhyggeligt udført nonkirurgisk behandling er stadig hjørnestenene i behandlingen og forudsætningen for al videre behandling.
Konklusioner
Kontrol med den mikrobielle biofilm er det primære mål for forebyggelse og behandling af parodontale sygdomme.
Plakfjernelse foretaget af patienten eller en fagperson tilbageruller den bakterielle dysbiose.
Sufficient mundhygiejne og professionel støttebehandling (trin 4) er de afgørende faktorer for opnåelse af et langtidsholdbart resultat efter aktiv parodontalbehandling (trin 1-3).
Anvendelse af antibiotika til kontrol af bakteriel biofilm anbefales ikke.
På nuværende tidspunkt kan anvendelse af endemål, der baserer sig på mikrobiologiske tests, ikke anbefales.
Referanse
Sanz M, Herrera D, Kebschull M et al. Treatment of stage I-III periodontitis-the EFP S3 level clinical practice guideline. J Clin Periodontol. 2020;47 (Supp 22):4-60.
Löe H, Theilade E, Jensen SB. Experimental gingivitis in man. J Periodontol. (1930) 1965;36:177-87.
Axelsson P, Lindhe J. Effect of controlled oral hygiene procedures on caries and periodontal disease in adults. Results after 6 years. J Clin Periodontol. 1981;8:239-48.
Lindhe J, Westfelt E, Nyman S et al. Long-term effect of surgical/non-surgical treatment of periodontal disease. J Clin Periodontol. 1984;11:448-58.
Breininger DR, O’Leary TJ, Blumenshine RV. Comparative effectiveness of ultrasonic and hand scaling for the removal of subgingival plaque and calculus. J Periodontol. 1987;58:9-18.
Caffesse RG, Sweeney PL, Smith BA. Scaling and root planing with and without periodontal flap surgery. J Clin Periodontol. 1986;13:205-10.
Matia JI, Bissada NF, Maybury JE et al. Efficiency of scaling of the molar furcation area with and without surgical access. Int J Periodontics Restorative Dent. 1986;6:24-35.
Waerhaug J. Healing of the dento-epithelial junction following subgingival plaque control. II: as observed on extracted teeth. J Periodontol. 1978;49:119-34.
Nyman S, Westfelt E, Sarhed G et al. Role of “diseased” root cementum in healing following treatment of periodontal disease. A clinical study. J Clin Periodontol. 1988;15:464-8.
Liss A, Wennström JL, Welander M et al. Patient-reported experiences and outcomes following two different approaches for non-surgical periodontal treatment: a randomized field study. BMC Oral Health. 2021;21:645.
Tomasi C, Liss A, Welander M et al. A randomized multi-centre study on the effectiveness of non-surgical periodontal therapy in general practice. J Clin Periodontol. 2022;49:1092-105.
Belibasakis GN, Belstrøm D, Eick S et al. Periodontal microbiology and microbial etiology of periodontal diseases: historical concepts and contemporary perspectives. Periodontol 2000. 2023;Jan 20
Van Dyke TE, Bartold PM, Reynolds EC. The nexus between periodontal inflammation and dysbiosis. Front Immunol. 2020;11:511.
Curtis MA, Diaz PI, Dyke TEV. The role of the microbiota in periodontal disease. Periodontol 2000. 2020;83:14-25.
Dahlén G, Lindhe J, Sato K et al. The effect of supragingival plaque control on the subgingival microbiota in subjects with periodontal disease. J Clin Periodontol. 1992;19:802- 9.
McNabb H, Mombelli A, Lang NP. Supragingival cleaning 3 times a week. The microbiological effects in moderately deep pockets. J Clin Periodontol. 1992;19:348-56.
Elkerbout TA, Slot DE, Rosema NAM et al. How effective is a powered toothbrush as compared to a manual toothbrush? a systematic review and meta‐analysis of single brushing exercises. Int J Dent Hyg. 2020;18:17-26.
Rosier BT, Marsh PD, Mira A. Resilience of the oral microbiota in health: mechanisms that prevent dysbiosis. J Dent Res. 2018;97:371-80.
Hajishengallis G, Darveau RP, Curtis MA. The keystone-pathogen hypothesis. Nat Rev Microbiol. 2012;10:717-25.
Lamont RJ, Koo H, Hajishengallis G. The oral microbiota: dynamic communities and host interactions. Nat Rev Microbiol. 2018;16:745-59.
Chen C, Hemme C, Beleno J et al. Oral microbiota of periodontal health and disease and their changes after nonsurgical periodontal therapy. ISME J. 2018;12:1210-24.
Haffajee AD, Teles RP, Socransky SS. The effect of periodontal therapy on the composition of the subgingival microbiota. Periodontol 2000. 2006;42:219-58.
Laksmana T, Kittichotirat W, Huang Y et al. Metagenomic analysis of subgingival microbiota following non-surgical periodontal therapy: a pilot study. Open Dent J. 2012;6:255-61.
Schwarzberg K, Le R, Bharti B et al. The personal human oral microbiome obscures the effects of treatment on periodontal disease. PLoS ONE. 2014;9:e86708.
Shi B, Chang M, Martin J et al. Dynamic changes in the subgingival microbiome and their potential for diagnosis and prognosis of periodontitis. mBio. 2015;6:e01926-14.
Marsh PD. Microbial ecology of dental plaque and its significance in health and disease. Adv Dent Res. 1994;8:263-71.
Mombelli A, Nyman S, Brägger U et al. Clinical and microbiological changes associated with an altered subgingival environment induced by periodontal pocket reduction. J Clin Periodontol. 1995;22:780-7.
Tanner ACR, Kent R, Kanasi E et al. Clinical characteristics and microbiota of progressing slight chronic periodontitis in adults. J Clin Periodontol. 2007;34:917-30.
Ramseier CA, Woelber JP, Kitzmann J et al. Impact of risk factor control interventions for smoking cessation and promotion of healthy lifestyles in patients with periodontitis: a systematic review. J Clin Periodontol. 2020;47 (Supp 22):90-106.
Camelo-Castillo AJ, Mira A, Pico A et al. Subgingival microbiota in health compared to periodontitis and the influence of smoking. Front Microbiol. 2015;6:119.
Ganesan SM, Dabdoub SM, Nagaraja HN et al. Adverse effects of electronic cigarettes on the disease-naive oral microbiome. Sci Adv. 2020;6:eaaz0108.
Delima SL, McBride RK, Preshaw PM et al. Response of subgingival bacteria to smoking cessation. J Clin Microbiol. 2010;48:2344-9.
Fullmer SC, Preshaw PM, Heasman PA et al. Smoking cessation alters subgingival microbial recolonization. J Dent Res 2009;88:524 - 8.
Liu KH, Hwang SJ. Effect of smoking cessation for 1 year on periodontal biomarkers in gingival crevicular fluid. J Periodontal Res. 2016;51:366-75.
Lahdentausta L, Paju S, Mäntylä P et al. Smoking confounds the periodontal diagnostics using saliva biomarkers. J Periodontol. 2019;90:475-83.
Hsu YT, Nair M, Angelov N et al. Impact of diabetes on clinical periodontal outcomes following non‐surgical periodontal therapy. J Clin Periodontol. 2019;46:206-17.
Kang S, Liu Z-Y, Yuan H-H et al. The impact of different states of type 2 diabetes when stratified by baseline HbA1c on the periodontal outcomes of non‐surgical periodontal treatment: a systematic review and network meta‐analysis. Int J Dent Hyg. 2024;22:401-13
Wang L, Gao Z, Zhao Z et al. Oral microbiota in periodontitis patients with and without type 2 diabetes mellitus and their shifts after the nonsurgical periodontal therapy. Heliyon. 2023;9:e22110.
Liu LS, Gkranias N, Farias B et al. Differences in the subgingival microbial population of chronic periodontitis in subjects with and without type 2 diabetes mellitus – a systematic review. Clin Oral Investig. 2018;22:2743-62.
Krajewski A, Perussolo J, Gkranias N et al. Influence of periodontal surgery on the subgingival microbiome – a systematic review and meta‐analysis. J Periodontal Res. 2023;58:308-24.
Loos B, Claffey N, Crigger M. Effects of oral hygiene measures on clinical and microbiological parameters of periodontal disease. J Clin Periodontol. 1988;15:211-6.
Sbordone L, Ramaglia L, Gulletta E et al. Recolonization of the subgingival microflora after scaling and root planing in human periodontitis. J Periodontol. 1990;61:579-84.
Califf KJ, Schwarzberg-Lipson K, Garg N et al. Multi-omics analysis of periodontal pocket microbial communities pre- and posttreatment. mSystems. 2017;2:e00016-7.
Hasturk H, Kantarci A, Goguet-Surmenian E et al. Resolvin E1 regulates inflammation at the cellular and tissue level and restores tissue homeostasis in vivo. J Immunol. 2007;179:7021-9.
Loos BG, Needleman I. Endpoints of active periodontal therapy. J Clin Periodontol 2020;47(Supp 22):61-71.
Haffajee AD, Socransky SS, Smith C et al. Microbial risk indicators for periodontal attachment loss. J Periodontal Res. 1991;26:293-6.
Kinney JS, Morelli T, Oh M et al. Crevicular fluid biomarkers and periodontal disease progression. J Clin Periodontol. 2014;41:113-20.
Wennström JL, Dahlén G, Svensson J et al. Actinobacillus actinomycetemcomitans, Bacteroides gingivalis and Bacteroides intermedius: predictors of attachment loss? Oral Microbiol Immunol. 1987;2:158-63.
Bostanci N, Belibasakis GN. Precision periodontal care: from omics discoveries to chairside diagnostics. Clin Oral Investig. 2023;27:971-8.
Ko T-J, Byrd KM, Kim SA. The chairside periodontal diagnostic toolkit: past, present, and future. Diagnostics. (Basel) 2021;11:932.
Belibasakis GN, Lund BK, Weiner CK et al. Healthcare challenges and future solutions in dental practice: assessing oral antibiotic resistances by contemporary point-of-care approaches. Antibiotics. (Basel) 2020;9:810.
Kherad O, Peiffer-Smadja N. Karlafti L et al. The challenge of implementing less is more medicine: a european perspective. Eur J Intern Med. 2020;76:1-7.
Den norske tannlegeforening (NDA) TNDA. Gjør kloke valg kampanjen. [Set 2022 juni). Tilgængelig fra: URL: https://www.tannlegeforeningen.no/fag-og-politikk/faglige-rad-og-retningslinjer/gjor-kloke-valg-kampanjen.html.
Teughels W, Feres M, Oud V et al. Adjunctive effect of systemic antimicrobials in periodontitis therapy: a systematic review and meta-analysis. J Clin Periodontol. 2020;47 (Supp 22):257-81.
Khattri S, Kumbargere Nagraj S, Arora A et al. Adjunctive systemic antimicrobials for the non-surgical treatment of periodontitis. Cochrane Database Syst Rev. 2020;11:CD012568.
Murray CJL, Ikuta KS, Sharara F et al. Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis. Lancet. 2022;399:629-55.
Thompson W, Williams D, Pulcini C et al. The essential role of the dental team in reducing antibiotic resistance. Geneva: FDI World Dental Federation. 2020.
English summary
Biofilm control in the management of periodontitis
Periodontitis is one of the most common non-communicable diseases in adults. Despite being considered as a multifactorial inflammatory disease, the primary cause of periodontitis is a dysbiotic bacterial biofilm resulting in an adverse host response. Therefore, biofilm control represents the primary target of prevention (including primordial, primary and secondary prevention) as well as treatment. This text discusses approaches to clinical management, summarizing the guideline presented by the European Federation of Periodontology. We also present the latest understanding how biofilm control affects bacterial dysbiosis and evaluate the potential role of systemic antibiotics and «endpoint» testing of bacterial biofilm.
Leppilahti J, Larsen T, Gussgard AM, Derks J. Biofilmkontrol ved behandling af parodontitis. Nor Tannlegeforen Tid. 2025;135:24-8. doi:10.56373/2025-1-6
Emneord: Periodontitis; therapy; bacterial biofilm
Akseptert for publisering 24.06.2024. Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Leppilahti J, Larsen T, Gussgard AM, Derks J. Biofilmkontrol ved behandling af parodontitis. Nor Tannlegeforen Tid. 2025;135:24-8. doi:10.56373/2025-1-6
