Lina Stangvaltaite-Mouhat, Lisa Grönroos, Kim Ekstrand och Kåre Buhlin
Biofilmsinducerade orala sjukdomar
Senior researcher, DDS, MPH, PhD, Oral Health Center of Expertise in Eastern Norway, Oslo, Norway.
University lecturer, DDS, PhD, Department of Oral and Maxillofacial diseases, University of Helsinki; Helsinki University Hospital, Helsinki, Finland.
Prof, DDS, PhD, Section for Cariology and Endodontics, Department of Odontology, University of Copenhagen, Denmark.
Docent, DDS, PhD, Division of Periodontology, Department of Dental Medicine, Karolinska Institutet, Huddinge, Sweden; Department of Oral and Maxillofacial diseases, University of Helsinki and Helsinki University Hospital, Helsinki, Finland.
Karies och parodontala sjukdomar är biofilmsinducerade sjukdomar i munhålan. I synnerhet parodontala sjukdomar är också förknippade med flera systemiska tillstånd. Viktiga metoder för oral sjukdomskontroll är att upprätthålla en god munhygien och disciplinerad kost.
De vanligaste orala sjukdomarna, karies och gingivit/parodontit/mukosit/periimplantit, anses vara icke-smittsamma biofilmsinducerade sjukdomar [1][2][3][4][5]. Denna artikel behandlar etiologin och patogenesen av karies och parodontala sjukdomar, ger en översikt av deras epidemiologi i de nordiska länderna och deras kopplingar till systemiska sjukdomar samt diskuterar vanliga riskfaktorer och strategier för att kontrollera dessa biofilmsinducerade orala sjukdomar.
Författarna bekräftar påverkan av socioekonomiska förhållanden och begränsad tillgång till vård på landsbygden samt i avlägsna områden. Detta leder till ojämlikheter i munhälsa även i de nordiska länderna. På grund av begränsat utrymme behandlar dock den här artikeln inte detta viktiga område.
Definition, etiologi och patogenes
Karies
Karies är en biofilmsmedierad, kostmodulerad, multifaktoriell, icke-smittsam, dynamisk sjukdom som resulterar i nettomineralförlust av tandens hårdvävnader [2][3]. Som ett resultat av denna process utvecklas en karieslesion [4].
Figur I illustrerar kariesdefinitionen, modifierad från den modell som utformades av Fejerskov och Manji 1990 [6]. De vita rutorna illustrerar de nödvändiga faktorerna (i fet stil) för att karies ska utvecklas; en tand, plackansamlingsområden på tanden (plaque stagnation areas on the tooth, PSA) och att pH sjunker på grund av metaboliska processer i biofilmen när fermenterbara kolhydrater bryts ner av strikta eller fakultativa anaeroba bakterier (SA/FA) över tid. På grund av dessa processer övergår biofilm från symbios till dysbios (acidogena och aciduriska bakterier dominerar) [3][5].
Resultatet av upprepade pH-fall är den gradvisa demineraliseringen av dental hårdvävnad (röda pilar i figur I). De biologiska determinanterna (i kursiv stil) verkar på tandytenivå och de kan påverka progressionshastigheten för kariesläsioner om de nödvändiga faktorerna är närvarande. Till exempel kan fluorid bromsa progressionshastigheten, medan minskade mängder saliv kan öka den. Den yttre sextanten visar avlägsna determinanter, vilka tandläkare vanligtvis inte har någon kontroll över och som påverkar kariesprocessen genom de biologiska determinanterna som verkar på tandytenivå och på de nödvändiga faktorerna.
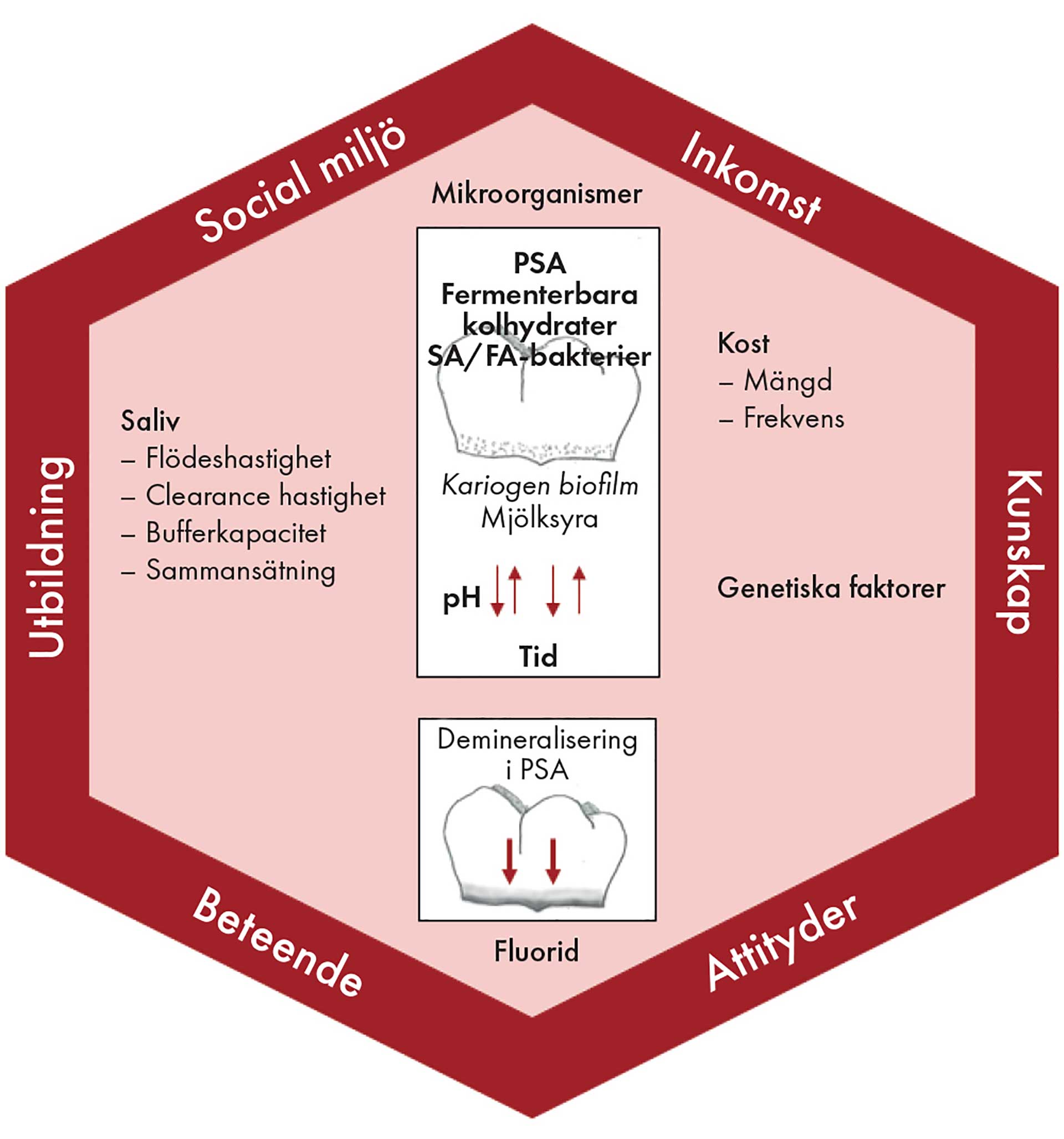
Figur 1. Etiologin för karies. Modifierad från Fejerskov og Manji 1990 [6].
När pH-värdet i biofilmen sjunker under cirka 5,5 löses emaljkristallerna, som huvudsakligen består av hydroxiapatit (HAP), gradvis upp. När pH åter stiger över 5,5 sker utfällning av HAP. Karies är således en dynamisk process som består av perioder av de- och remineralisering. Om demineralisering sker oftare än remineralisering utvecklas kariesskador. Eftersom remineraliseringen främst sker på tandytenivå, är den tidiga emaljskadan strukturerad som en ytskada, såväl som en läsion under ytan där större delen av läsionen är belägen [7][8].
På grund av fluoridens kemiska natur spelar den konsekvent en roll i remineraliseringsprocessen genom att fälla ut fluoridhydroxiapatit (FHAP). Eftersom FHAP har en lägre solubiliseringsprodukt än HAP, det vill säga ett lägre kritiskt pH-värde, kommer FHAP inte att lösas upp under de följande pH-sänkningarna i biofilmen. Således bidrar fluorid till remineralisering och bromsar demineraliseringen, och vid höga koncentrationer fungerar fluorid som ett bakteriostatiskt medel [9].
Mjölksyra och andra organiska syror tränger in i emaljen mellan prismor, på grund av större porvolymer jämfört med prismakärnor. Emaljskador varierar i form baserat på prismats riktning. I dentin, med sitt högre organiska innehåll, löser proteolytiska enzymer från bakterier upp organisk vävnad i samma riktning som dentinkanalerna [8].
Parodontala och periimplantära sjukdomar
Den 2017 utgivna «Classification of periodontal and peri-implant diseases and conditions» ger ett omfattande ramverk för parodontala och periimplantatrelaterade sjukdomar och tillstånd som inte baseras på ålder eller åldersrelaterade mönster [10]. Detta är klassificeringen i korthet:
Gingival och parodontal hälsa. Detta refererar till frånvaron av inflammation associerad med gingivit eller parodontit. Det kan bedömas både histologiskt och kliniskt [11]. Detta gäller både på ett intakt parodontium och på ett reducerat parodontium.
Gingivit. Tandköttsblödning på 10 procent eller mer av det totala antalet ytor utan marginal benförlust [12].
Parodontit. Detta är en viktig kategori i klassificeringen och den har delats upp ytterligare i stadier och grader för en mer utförlig diagnos [13]. Riskfaktorer såsom oral biofilm, rökning och diabetes mellitus beaktas också.
Detta system klassificerar inte bara olika sjukdomar och tillstånd utan ger också en struktur för behandlingsplanering och övervakning av en patients svar på behandlingen [14].
Parodontala sjukdomar, det vill säga gingivit och parodontit, kännetecknas främst av inflammation. Den parodontala sjukdomens patogenes är en komplex process som involverar interaktioner mellan oral biofilm, inflammation och värdens immunsvar. Munhålan är hem för en mängd olika mikroorganismer, som tillsammans kallas det orala mikrobiomet [15]. Vid hälsa föreligger en balanserad interaktion mellan dessa mikrober, värden och den lokala miljön. Denna balans är avgörande för munhälsan eftersom den förhindrar överväxt av opportunistiska patogener och förstärker immunsystemet [16].
De begrepp som introduceras och diskuteras i dag är «keystone-pathogen hypothesis» (KPH) och oral dysbios [17]. Tanken bakom KPH är att mikrobiella patogener kan orsaka en inflammatorisk reaktion genom sammansättningen och mängden av den normala mikrofloran. Oral dysbios innebär förändringar i det orala mikrobiomet, vilket leder till en ökning av skadliga bakterier och en minskning av nyttiga bakterier [17][18].
Vid sjukdom sker en förskjutning i balansen i munhålan. Det traditionella sättet att undersöka detta är genom klinisk undersökning – marginell benförlust, blödning vid sondering, fickdjup och mikrobiologisk provtagning – inklusive röntgenbilder. Detta fungerar bra, men nya studier från Finland har adderat ett nytt sätt att bedöma sjukdomsaktivitet. Forskarna har undersökt en inflammatorisk markör för kollagenas 2 (Matrix Metalloproteinase-8 (MMP-8)), som spelar en roll i parodontal patogenes. Det är känt att förhöjda nivåer av MMP-8 kan hittas i saliv, tandköttsvätska och periimplantärsulcusvätska [19]. MMP-8 är en av de mest lovande biomarkörerna för parodontit i orala vätskor, men även andra biomarkörer har diskuterats. Dessa typer av tester kan bli ett användbart kompletterande verktyg tillsammans med den kliniska undersökningen för parodontitdiagnos och bedömning av framtida risk.
Periimplantära sjukdomar, främst periimplantit, är ett inflammatoriskt tillstånd som kan uppstå efter en osseointegrerad tandimplantatbehandling, som påverkar både de omgivande hård- och mjukvävnaderna. Tillståndet utvecklas på grund av ackumulering av biofilm, såsom vid parodontit [20]. Dålig munhygien, tidigare parodontit och rökning är de vanligaste orsakerna till periimplantit och implantatförlust [20][21][22]. På grund av en prevalens på upp till 50 procent bör strategier för förebyggande och behandling av periimplantär sjukdom integreras i moderna rehabiliteringskoncept inom tandvården [23][24][25][26].
Periimplantit kan vara asymtomatisk, men visar oftast kliniska tecken på blödning vid sondering, ökande sonddjup, suppuration, slemhinnesvullnad runt implantatet och benförlust [27].
Biofilmsinducerade orala sjukdomar och systemiska sjukdomar
Parodontit är, på grund av låggradig inflammation, kopplad till flera systemiska hälsotillstånd och anses vara en riskfaktor eller indikator för sjukdomar såsom hjärt- och kärlsjukdomar, diabetes mellitus, neurodegenerativa sjukdomar och cancer [28][29][30]. Parodontal inflammation har också associerats med dödlighet oavsett orsak och i hjärt-kärlsjukdomar [31]. Karies har på liknande sätt förknippats med tillstånd såsom diabetes mellitus, fetma och astma, men kliniska bevis som kopplar karies till systemiska sjukdomar är begränsade [32].
Även om vissa samband mellan orala och systemiska sjukdomar är väletablerade, är det direkta orsakssambandet fortfarande oklart. Det föreslås att sambandet mellan orala sjukdomar och dödlighet kan påverkas av andra faktorer, vilket gör munhälsa till en markör för socioekonomiska och beteendemässiga riskfaktorer som är förknippade med dödlighet oavsett orsak [33].
Integrerad hypotes om karies och parodontala sjukdomar
År 2020 lanserade Nyvad och Takahashi [5] en intressant hypotes som innebär att både karies och parodontala sjukdomar utvecklas som svar på näringsmässiga obalanser i den orala biofilmen. Det har varit känt i årtionden att överdrivet intag av fermenterbara kolhydrater leder till bildning av organiska syror och därmed demineralisering av tandens hårda vävnader. Denna nya hypotes föreslår att överdrivet intag av fermenterbara kolhydrater kan bidra till inflammation i parodontala vävnader på grund av hyperglykemi.
Epidemiologi för biofilmsinducerade orala sjukdomar i de nordiska länderna
Fakta 1 visar förekomsten av karies och parodontala sjukdomar i de nordiska länderna i syfte att illustrera den senaste epidemiologin snarare än att jämföra länderna.
Kariesförekomsten bland barn och ungdomar var hög under 1970- och 1980-talen men har minskat markant i samtliga nordiska länder, om än långsammare på Island. I Danmark, och förmodligen även i andra nordiska länder, har ungefär hälften av 15-åringarna inte någon DMFT och ungefär en fjärdedel har bara en eller två tänder med DMFS [34]. Kommande data tyder dock på en ökning av tandvård under narkos bland barn i vissa nordiska länder [35]. Den minskade kariesförekomsten hos barn och ungdomar har lett till en liknande minskning hos vuxna.
Parodontala sjukdomar är vanliga i de nordiska länderna. Även om prevalensen har minskat under de senaste 40 åren, upplever cirka 80 procent av individer över 35 år fortfarande någon form av tandköttsrelaterade problem [36].
Demografiska förändringar och det ökande antalet äldre som behåller sina tänder är en utmaning, eftersom tandsjukdomar i de nordiska länderna i dag främst drabbar denna åldersgrupp [37].
Epidemiologi i de nordiska länderna för biofilmsinducerade orala sjukdomar. Data är baserat på nationella enstaka studier. Vid intresse, skicka referensförfrågan till författarna.
Danmark
Kariesförekomst 2008–2022
DMFS 1,2 hos 15-åringar (hela landet).
DMFS, speciellt F-komponenten, är hög hos ≥ 65-åringar (baserat på en studie).
Mer än 75 procent av ≥ 65-åringar har > 20 tänder, färre än 10 procent har en full tanduppsättning (baserat på enstaka studier).
Parodontit 2006
1/3 av samtliga deltagare uppvisade blödning vid sondering; 20 procent av de yngsta till nästan 40 procent i den äldsta gruppen (baserat på en studie).
40 procent av 18–75-åringar hade en genomsnittlig klinisk fästeförlust på ≥ 3mm, 4 procent hos 18–34-åringar, 80 procent av ≥ 65-åringar (baserat på en studie).
Finland
Kariesförekomst 2011
DMF på 4,1 hos finska värnpliktiga (baserat på enstaka studier).
Parodontit 2000–2011
PPD ≥ 6 mm (åtminstone en ficka) var 6 procent hos 30–34-åringar och 14 procent hos 35–44-åringar år 2000 (baserat på en studie).
Liknande data observerades år 2011(baserat på enstaka studier).
Island
Kariesförekomst 2010
DMFT 0,12 hos 6-åringar, 1,43 hos 12-åringar och 2,78 hos 15-åringar (baserat på en studie).
DMFT var det dubbla om röntgen inkluderades (baserat på en studie).
Parodontit 2022
Prevalens av allvarlig parodontit var 17,7 procent bland 15+-åringar (baserat på en studie).
Norge
Kariesförekomst 2017–2022
defs/DMFT 0,2 bland 3-åringar; 0,7 bland 5-åringar; 1,8 bland 15-åringar; 2,8 bland 18-åringar (hela landet).
DMFT 10,8 procent bland 35–44-åringar; 21 bland ≥ 65-åringar (baserat på en studie).
Parodontit 2017–2019
Prevalens av parodontit var 53 procent och allvarlig parodontit 36 procent bland 65-åringar (baserat på en studie).
PPD ≥ 6mm var 9 procent bland 19–94-åringar (baserat på en studie).
Sverige
Kariesförekomst 2019
dfs > 0 hos cirka 5 procent av 3-åringar (hela landet).
DFS > 0 hos cirka 1/3 av 12-åringar, 60 procent av 19-åringar har DMFS vilket sjunker till 58 procent år 2019 (hela landet).
Parodontit 2013
55 procent av 20–80-åringar lider av parodontala sjukdomar (baserat på en studie).
PPD ≥ 6 mm var 12 procent bland 30-åringar (baserat på en studie).
PPD ≥ 6 mm var 38 procent bland 70-åringar (baserat på en studie).
Kontroll av biofilmsinducerade orala sjukdomar
Riskfaktorer för biofilmsinducerade orala sjukdomar kan vara både modifierbara och icke-modifierbara. Icke-modifierbara riskfaktorer, som faller utanför tandvårdspersonalens och patientens kontroll, inkluderar till exempel genetik, socioekonomisk miljö och tandvårdssystemen i de olika länderna. Faktum är att både karies och parodontala sjukdomar delar vissa riskfaktorer som också är gemensamma för andra icke-smittsamma systemiska sjukdomar, främst livsstil [38][39].
Enligt «Integrated hypothesis of dental caries and periodontal diseases» [5] är de viktigaste gemensamma riskfaktorerna för karies och parodontala sjukdomar dental biofilm och fermenterbara kolhydrater. De kan modifieras om en patient och tandvårdspersonal arbetar tillsammans. Grunden är daglig munhygien [40].
Utöver strategin att angripa de gemensamma riskfaktorerna, påverkar skillnader hur vi kontrollerar dem (tabell 1). Detta då patogenesen vid de parodontala sjukdomarna (som är inflammatoriska, icke-smittsamma sjukdomar) utlöser en överväxt av proteolytiska bakterier jämfört med karies som också en icke-smittsam sjukdom, men utan några inflammatoriska komponenter i sina tidiga stadier.
I de nordiska länderna är tandborstning två gånger om dagen det mest accepterade sättet att kontrollera parodontala sjukdomar (tabell 1). Om tandkrämen innehåller fluorid minskar den också karies avsevärt (preventiv fraktion på 25 procent) [9][43]. För patienter med hög risk för karies har dessutom högre fluoridkoncentrationer en större kariesreducerande effekt än lägre koncentrationer [9][43]. Slutligen förespråkar tandvården i första hand lokal snarare än systemisk applicering av fluorid för att kontrollera karies [9][43].
Metoder (referenser, exempel) |
Kontroll av karies |
Kontroll av parodontala sjukdomar |
|---|---|---|
Tandborstning två gånger om dagen [1, 41–48] |
+1 |
+1 |
Rengöring av interdentala utrymmen [1, 41, 42, 44–47] |
+2 |
+2 |
Professionell munhygien [1, 42–45, 48] |
+3 |
+3 |
Vägledning om god munhygien [1, 41–48] |
+4 |
+4 |
Tennfluroid eller en kombination av amin och tennfluoridtandkräm och munsköljningar [41, 42, 44, 45] |
+5 |
+5 |
Kostvägledning [1, 41, 43, 44, 46–48] |
+6 |
+6 |
Klorhexidin [42, 44, 45, 48] |
(+)7 |
(+)7 |
Rökstopp [41, 42, 45, 46] |
+8 |
+8 |
Sodiumfluorid eller sodiummonofluorfosfatflourid sugtabletter/tabletter/tuggummin, munsköljmedel, tandkrämer, tandkräm med 5 000 ppm F [1, 9, 43, 44, 46–48] |
+9 |
|
Xylitolprodukter [1, 44] |
+ |
|
Fissurförsegling [1, 43, 44, 46–48] |
+ |
|
Fluoridgel i en skena [1, 43, 44, 46–48] |
+ |
|
Fluoridlack [9, 43, 44, 46–48] |
+ |
|
Resininfiltration [1, 44, 48] |
+ |
|
Silverdiaminfluorid [44] |
+10 |
|
Scaling och rotplaning [45, 48] |
+ |
|
Antibakteriell läkemedelsbehandling [45, 48] |
+ |
|
Eteriska oljor eller cetylpyridinklorid [45, 48] |
+ |
1 stark effekt på karies och gingivit separat, begränsade bevis för samtidig effekt.
2 otillräcklig evidens för karies, låg till mycket låg säkerhet för gingivit/plack.
3 begränsade bevis för återkallelseintervall.
4 inte testas samtidigt; ingen signifikant effekt.
5 en relevant inverkan på plack och/eller gingivit och karies när det testas separat.
6 testas inte samtidigt.
7 endast för särskilda grupper för kontroll av munhygien; ej testade samtidigt.
8 tydliga bevis på parodontit och viss indikation på karies.
9 fluoridtillskott med lägre koncentration, t.ex. sugtabletter/tabletter/tuggummi, har lägre kariesreducerande effekt.
10 ej tillgänglig i alla nordiska länder.
Slutsats
Karies och parodontala sjukdomars etiologi och patogenes är väl kända. Båda är enligt de senaste definitionerna biofilmsinducerade orala sjukdomar. Den nya integrerade hypotesen om karies och parodontala sjukdomar tyder på att de delar gemensamma riskfaktorer och bör kontrolleras samtidigt genom fokusering på adekvat munhygien och disciplinerad kost, särskilt när det gäller fermenterbara kolhydrater. Eftersom sjukdomarnas patogenes är olika kan varje sjukdom hanteras ytterligare genom individuella icke-operativa och operativa åtgärder.
Referenser
Meyer-Lueckel H, Paris S, Ekstrand KR. Caries management – science and clinical practice. Thieme, Stuttgart 2013.
Fejerskov O. Concepts of dental caries and their consequences for understanding the disease. Community Dent Oral Epidemiol. 1997; 25: 5–12.
Pitts NB, Zero DT, Marsh PD, Ekstrand K, Weintraub JA, Ramos-Gomez F et al. Dental caries. Nat Rev Dis Primers. 2017; 3: 17030.
Machiulskiene V, Campus G, Joana Christina Carvalho JC, Dige I, Ekstrand KR et al. Terminology of dental caries and dental caries management: Consensus report of a workshop organized by ORCA and Cariology Research Group of IADR. Caries Res. 2020; 54: 7–14.
Nyvad B, Takahashi N. Integrated hypothesis of dental caries and periodontal diseases. J Oral Microbiol. 2020; 12: 1710953.
Fejerskov O, Manji F. Risk assessment. In: Bader I, ed. Risk assessment in dentistry. Chapel Hill, NC: University of North Carolina Dental Ecology, 1990: 215–7.
Shellis P. Etiology and pathogenesis of caries. In Meyer-Lueckel H, Paris S and Ekstrand KR, ed. Caries management – science and clinical practice. Thieme, Stuttgart 2013, pp 23–35.
Buchalla W. Histological and clinical appearance of caries. In Meyer-Lueckel H, Paris S and Ekstrand KR, ed. Caries management – science and clinical practice. Thieme, Stuttgart 2013, pp 40–59.
Twetman S, Ekstrand KR: Caries management by influencing mineralization: In Meyer-Lueckel H, Paris S and Ekstrand K, ed. Caries management – science and clinical practice, Thieme, Stuttgart 2013, pp 177–90.
Holmstrup P, Bunaes D, Gursoy M, Lundberg P. Den nya klassificeringen av parodontit. Tandläkartidningen. 2022; 1: 50–7.
Lang NP, Bartold PM. Periodontal health. J Periodontol. 2018; 89 Suppl 1: S9–S16.
Trombelli L, Farina R, Silva CO, Tatakis DN. Plaque-induced gingivitis: Case definition and diagnostic considerations. J Clinical Periodontol. 2018; 45 Suppl 20: S44–S67.
Papapanou PN, Sanz M, Buduneli N, Dietrich T, Feres M, Fine DH et al. Periodontitis: Consensus report of workgroup 2 of the 2017 World Workshop on the Classification of Periodontal and Peri-Implant Diseases and Conditions. J Periodontol. 2018; 89 Suppl 1: S173–S182.
El Sayed N, Rahim-Wostefeld S, Stocker F, Behnisch R, Eickholz P, Pretzl B. The 2018 classification of periodontal diseases: Its predictive value for tooth loss. J Periodontol. 2022; 93: 560–9.
Dewhirst FE, Chen T, Izard J, Paster BJ, Tanner AC, Yu WH et al. The human oral microbiome. J Bacteriol. 2010; 192: 5002–17.
Marsh PD. Microbial ecology of dental plaque and its significance in health and disease. Adv Dent Res. 1994; 8; 263–71.
Hajishengallis G, Darveau RP, Curtis MA. The keystone-pathogen hypothesis. Nat Rev Microbiol. 2012; 10: 717–25.
Duran-Pinedo A, Solbiati J, Teles F, Teles R, Zang Y, Frias-Lopez J. Long-term dynamics of the human oral microbiome during clinical disease progression. BMC Biol. 2021; 19: 240.
Sorsa T, Tjäderhane L, Konttinen YT, Lauhio A, Salo T, Lee HM et al. Matrix metallo-proteinases: contribution to pathogenesis, diagnosis and treatment of periodontal inflammation. Ann Med. 2006; 38: 306–21.
Schwarz F, Derks J, Monje A, Wang HL. Peri-implantitis. J Clin Periodontol .2018; 45: S246–S266.
French D, Grandin HM, Ofec R. Retrospective cohort study of 4,591 dental implants: Analysis of risk indicators for bone loss and prevalence of peri-implant mucositis and peri-implantitis. J Periodontol. 2019; 90: 691–700.
Renvert S, Quirynen M. Risk indicators for peri-implantitis. A narrative review. Clin Oral Implants Res. 2015; 26 (Suppl 11): 15–44.
Rodrigo D, Sanz-Sánchez I, Figuero E, Llodrá JC, Bravo M, Caffesse RG et al. Prevalence and risk indicators of peri-implant diseases in Spain. J Clin Periodontol. 2018; 45: 1510–20.
Roos-Jansåker AM, Lindahl C, Renvert H, Renvert S. Nine- to fourteen-year follow-up of implant treatment. Part II: Presence of peri-implant lesions. J Clin Periodontol. 2006; 33: 290–5.
Diaz P, Gonzalo E, Villagra LJG, Miegimolle B, Suarez MJ. What is the prevalence of peri-implantitis? A systematic review and meta-analysis. BMC Oral Health. 2022; 22: 449.
Astolfi V, Ríos-Carrasco B, Gil-Mur FJ, Ríos-Santos JV, Bullón B, Herrero-Climent M et al. Incidence of peri-implantitis and relationship with different conditions: a retrospective study. Int J Environ Res Public Health. 2022; 19: 4147.
Rokaya D, Srimaneepong V, Wisitrasameewon W, Humagain M, Thunyakitpisal P. Peri-implantitis update: risk indicators, diagnosis, and treatment. Eur J Dent. 2020; 14: 672–82.
Buhlin K, Eriksdotter M. Möjliga samband mellan orala sjukdomar och demens. Läkartidningen 2024; 121: 231–35.
Bui FQ, Almeida-da Silva CLC, Huynh B, Trinh A, Liu J, Woodward J et al. Association between periodontal pathogens and systemic disease. Biomed J. 2018; 42: 27–35.
Michaud DS, Lu J, Peacock-Villada AY, Barber JR, Joshu CE, Prizment AE et al. Periodontal disease assessed using clinical dental measurements and cancer risk in the ARIC Study. J Natl Cancer Inst 2018; 110: 843–54.
Pink C, Holtfreter B, Völzke H, Nauck M, Dorr M, Kocher T. Periodontitis and systemic inflammation as independent and interacting risk factors for mortality: evidence from a prospective cohort study. BMC Med 2023; 21: 430.
Sabharwal A, Stellrecht E, Scannapieco FA. Associations between dental caries and systemic diseases: a scoping review. BMC Oral Health 2021; 21: 472.
Sabbah W, Mortensen LH, Sheiham A, Batty GD. Oral health as a risk factor for mortality in middle-aged men: the role of socioeconomic position and health behaviours. J Epidemiol Community Health. 2013; 67: 392–7.
Ekstrand KR, Christiansen J, Christiansen C, Bakhshandeh A. Carieserfaringen i børne-og ungdomstandplejen i Danmark fra 1972-2022. En narrative fortolkning af succesen. Tandlægebladet. 2023; 127: 902–12.
Rajavaara P, Laitala ML, Vähänikkilä H, Anttonen V. Survey of family-related factors of children treated under dental general anaesthesia. Eur J Paediatr Dent. 2018; 19: 139–44.
Wahlin Å, Papias A, Jansson H, Norderyd O. Secular trends over 40 years of periodontal health and disease in individuals aged 20–80 years in Jönköping, Sweden: Repeated cross-sectional studies. J Clin Periodontol. 2018; 45: 1016–24.
Närhi T, Syrjälä A-M. Dental diseases and their treatment in the older population. Nor Tannlegeforen Tid. 2017; 127: 42–8.
Sheiham A, Watt RG. The common risk factor approach: a rational basis for promoting oral health. Community Dent Oral Epidemiol. 2000; 28: 399–406.
Watt RG, Sheiham A. Integrating the common risk factor approach into a social determinants framework. Community Dent Oral Epidemiol. 2012; 40: 289–96.
Pitts NB, Twetman S, Fisher J, Marsh PD. Understanding dental caries as a non-communicable disease. Br Dent J. 2021; 231: 749–53.
Chapple IL, Bouchard P, Cagetti MG, Campus G, Carra MC, Cocco F et al. Interaction of lifestyle, behaviour or systemic diseases with dental caries and periodontal diseases: consensus report of group 2 of the joint EFP/ORCA workshop on the boundaries between caries and periodontal diseases. J Clin Periodontol. 2017; 44 Suppl 18: S39–S51.
Jepsen S, Blanco J, Buchalla W, Carvalho JC, Dietrich T, Dörfer C et al. Prevention and control of dental caries and periodontal diseases at individual and population level: consensus report of group 3 of joint EFP/ORCA workshop on the boundaries between caries and periodontal diseases. J Clin Periodontol. 2017; 44 Suppl 18: S85S93.
Undervisningsvejledninger til tandlæger. 2024. Read 26.03.2024. URL: https://odont.ku.dk/fagomr/cariologi_endodonti/vejledninger-til-tandlaeger/
Karies(hantering). Current Care Guidelines. Working group set up by the Finnish Medical Society Duodecim and the Finnish Dental Society Apollonia. Helsinki: The Finnish Medical Society Duodecim. 2023. Read 06.02.2024. URL: www.kaypahoito.fi
Parodontit. Current Care Guidelines. Working group set up by the Finnish Medical Society Duodecim and the Finnish Dental Society Apollonia. Helsinki: The Finnish Medical Society Duodecim. 2021. Read 06.02.2024. URL: www.kaypahoito.fi
Nasjonal faglig retningslinje for tannhelsetjenester til barn og unge 0–20 år. 2018. Read 26.03.2024. URL: https://www.helsedirektoratet.no/retningslinjer/tannhelsetjenester-til-barn-og-unge-020-ar
Tannhelse – Helsefremmende og forebyggende tiltak for voksne over 20 år. 2019. Read 26.03.2024. URL: https://www.helsedirektoratet.no/faglige-rad/helsefremmende-og-forebyggende-tannhelsetiltak-for-voksne-over-20-ar
Nationella riktlinjer. Socialstyrelsen. 2022. Read 26.03.2024. URL: https://www.socialstyrelsen.se/kunskapsstod-och-regler/regler-och-riktlinjer/nationella-riktlinjer/riktlinjer-och-utvarderingar/tandvard/
English summary
What do we know about biofilm-induced diseases in the oral cavity?
Nor Tannlegeforen Tid. 2025; 135: 10-6.
Caries and periodontal/peri-implant diseases are two of the most common oral diseases, and, according to the most recent definitions, are considered non-communicable biofilm-induced diseases . In the 1970s, caries and periodontal diseases were prevalent across all Nordic countries. However, today, for most younger generation individuals, caries rates are very low, whilst gingivitis and periodontitis remain common in the adult populations of the Nordic countries. These dental diseases also affect the elderly due to longer tooth retention.
Caries and, in particular, periodontal diseases are associated with several systemic conditions, although a direct causality remains elusive, and the relationship may be partly explained by the other factors. According to the integrated hypothesis of dental caries and periodontal diseases, the biofilm is considered a common risk factor alongside fermentable carbohydrates. Therefore, these two oral diseases could be simultaneously controlled by addressing common risk factors. However, due to differences in pathogenesis, separate management procedures are recommended for each disease, which are well-integrated into the dental practices in the Nordic countries. In conclusion, etiology and pathogenesis are well described for caries and periodontal diseases. Both share some essential risk factors, but most importantly, management of these diseases requires adequate oral hygiene and discipline concerning fermentable carbohydrate intake.
Korresponderende forfatter: E-post: Kare.Buhlin@ki.se
Akseptert for publisering 18.07.2024. Artikkelen er fagfellevurdert
Del av den nordiska artikelserien Oral hygiene och översatt från engelska av Cecilia Hallström, Köpenhamn, Danmark
Artikkelen siteres som: Stangvaltaite-Mouhat L, Grönroos L, Ekstrand K, Buhlin K. Biofilmsinducerade orala sjukdomar – riskfaktorer och åtgärder. Nor Tannlegeforen Tid. 2025; 135: 10-6.
